
| A. | H2 | B. | Cl2 | C. | HCl | D. | O2 |
分析 惰性电极电解饱和氯化钠溶液,依据离子放电顺序,阳极是氯离子失电子发生氧化反应生成氯气,阴极是氢离子得到电子发生还原反应,阴极附近水的电离平衡被破坏,溶液中氢氧根离子浓度增大.
解答 解:惰性电极电解饱和氯化钠溶液,依据离子放电顺序,阳极是氯离子失电子发生氧化反应生成氯气,电极反应为:2Cl--2e-=Cl2↑,阴极是氢离子得到电子发生还原反应,电极反应为:2H++2e-=H2↑,阴极附近水的电离平衡被破坏,溶液中氢氧根离子浓度增大生成氢氧化钠溶液,所以阴极区产物为氢气和氢氧化钠,
故选A.
点评 本题考查了电解原理的分析应用,注意利用电解饱和食盐水溶液中离子放电顺序判断产物是解题关键,题目较简单.


科目:高中化学 来源: 题型:推断题
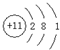 .C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).
.C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).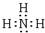 .检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.
.检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
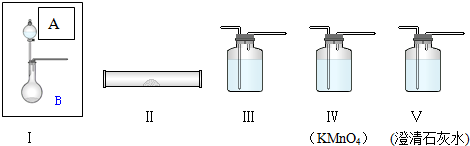
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g 46%的乙醇水溶液含有的氧原子数为0.4NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液1.0L,含有OH-数目0.2NA | |
| C. | 4.6g C2H6O含有的C-H键总数一定为0.5NA | |
| D. | 常温下,0.1mol Cl2溶于水转移的电子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH增大 | B. | CH3COOH的电离程度增大 | ||
| C. | 溶液的导电能力减小 | D. | 溶液中n(H+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、O、P元素的非金属性依次减弱 | |
| B. | Na、Mg、Al元素最高化合价依次升高 | |
| C. | Na、Li、K原子的电子层数依次增多 | |
| D. | P、Cl、S元素最高价氧化物对应的水化物酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O=HCl+HClO | B. | Fe+CuSO4=FeSO4+Cu | ||
| C. | 2NaHCO3 $\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2 | D. | Cl2+2FeCl2=3FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com