
【题目】下列实验操作能够达到实验目的的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加入少量水
B.实验室采用如图所示装置收集Cl2
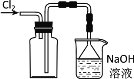
C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
D.用酒精萃取碘水中的碘单质
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】下表中相关物质的信息都正确的一项是( )
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A |
|
| 不稳定,易分解 | 医用消毒剂 |
B |
| 离子键、共价键 | 强氧化性 | 消毒液 |
C |
| 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D |
| 离子键 | 受热易分解 | 泡沫灭火器 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如图:
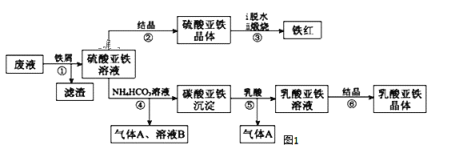
已知:乳酸可以和碳酸根生成二氧化碳气体。请回答:
(1)步骤④需控制反应温度低于35℃,其目的是___。
(2)步骤④反应的离子方程式是___。
(3)已知:FeCO3(s) Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因___。
(4)Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是___。
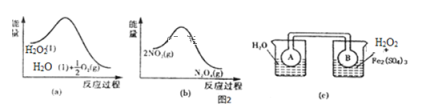
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断正确的是
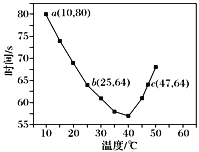
A.40 ℃之前,温度升高反应速率减慢,变蓝时间变长
B.40 ℃之后溶液变蓝的时间随温度的升高变短
C.图中b、c两点对应的NaHSO3的反应速率相等
D.图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+Y(?)aZ(g)此时Ⅰ中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是( )
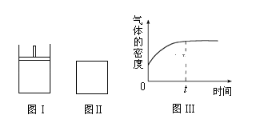
A.物质Z的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在海水综合利用中,下列叙述不正确的是( )
A.海水经过蒸发结晶得到粗盐
B.海水中提取镁单质的方法是海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
C.海水提镁的工艺中用贝壳为原料生产石灰乳
D.海水中提取溴单质可以用氯气将海水中的Br-氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面上的物种用“· ”标注,Ts表示过渡态。
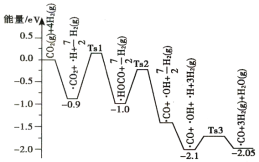
下列有关叙述正确的是
A.前三步总反应的△H<0
B.·HOCO转化为·CO和·OH为吸热过程
C.催化剂通过参与化学反应,能降低反应的活化能,提高反应物的转化率
D.历程中活化能(能垒)最小的反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有MoS2、CoS和Al2O3)中回收钴和钼的工艺流程如图:

已知:浸取液中的金属离子主要为MoO![]() 、Co2+、Al3+。
、Co2+、Al3+。
(1)钼酸铵[(NH4)2MoO4]中Mo的化合价为___,MoS2在空气中高温焙烧产生两种氧化物:SO2和___(填化学式)。
(2)酸浸时,生成MoO![]() 的离子方程式为___。
的离子方程式为___。
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取MoO![]() 和Co2+,萃取情况如图所示,当协萃比=___更有利于MoO
和Co2+,萃取情况如图所示,当协萃比=___更有利于MoO![]() 的萃取。
的萃取。

(4)向有机相1中滴加氨水,发生反应的离子方程式为___。
(5)Co2+萃取的反应原理为Co2++2HR![]() CoR2+2H+,向有机相2中加入H2SO4能进行反萃取的原因是___(结合平衡移动原理解释)。
CoR2+2H+,向有机相2中加入H2SO4能进行反萃取的原因是___(结合平衡移动原理解释)。
(6)水相2中的主要溶质除了H2SO4,还有___(填化学式)。
(7)Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,则阳极电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲乙两个电解池,请回答:
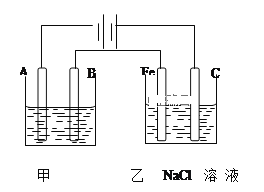
(1)甲池若为用电解原理精炼铜的装置,A极是__极,材料是___,B极电极反应方程式为___。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,___极(填“Fe”或“C”)附近变红色。
(3)若乙槽阳极放出气体在标准状况下的体积为2.24L,
①甲槽阴极增重___g。
②若乙槽电解后得到碱液的物质的量浓度为2moL/L,则乙槽剩余液体体积为__mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com