
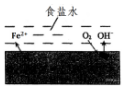
 在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )
在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )| A. | 铁片发生还原反应而被腐蚀 | |
| B. | 此过程中电子从C移向Fe | |
| C. | 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-═4OH- | |
| D. | 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀 |
分析 在一块表面无锈的铁片上滴食盐水,铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀,铁作负极,发生失电子的氧化反应,即Fe-2e-=Fe2+,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,电子从负极Fe移向正极C,据此分析解答.
解答 解:A、铁作负极,发生失电子的氧化反应,故A错误;
B、电子从负极Fe移向正极C,故B错误;
C、铁作负极,发生失电子的氧化反应,即Fe-2e-=Fe2+,故C错误;
D、在一块表面无锈的铁片上滴食盐水,铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀,铁作负极,碳作正极,故D正确;
故选;D.
点评 本题考查了金属的电化学腐蚀原理,明确铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀,难度不大.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②⑤①③④ | C. | ①③⑤②④ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 闭合开关K后,电流计 指针不发生偏转,证明酒精溶液是非电解质 指针不发生偏转,证明酒精溶液是非电解质 | |
| B. | 闭合开关,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质 | |
| C. | 取用0.1 mol•L-1的蔗糖溶液替换酒精溶液,电流计的示数相同,说明蔗糖是非电解质 | |
| D. | 闭合开关,往烧杯中加NaCl固体,虽然固体溶解,由于不反应,故电流计指针不发生偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
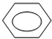 +HO-NO2→
+HO-NO2→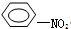 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).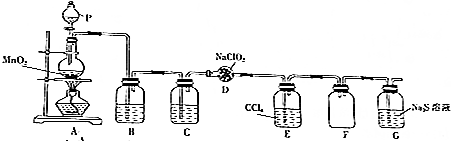
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com