
A.V1=100 V2 B.V2=100V1 C.V1=2V2 D.V2=2V1
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
 (1)写出下列物质溶于水的电离方程式①冰醋酸溶于水:
(1)写出下列物质溶于水的电离方程式①冰醋酸溶于水:| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸 溶液 |
MnSO4固体 | 0.10mol/L KMnO4溶液 |
褪色 时间 |
| 1 | 750℃ | ---- | --- | 1mL | 1OOs |
| 2 | 750℃ | 10滴 | ---- | 1mL | 40s |
| 3 | 750℃ | 10滴 | 加入少许 | 1mL | 3s |
| 实验步骤 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省烟台市高三上学期期末统考化学试卷(解析版) 题型:填空题
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示(某产物已略去):
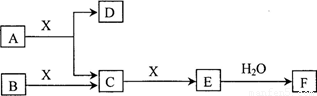
已知:B、X为单质,常温下D为无色液体,A、B含同一种元素。
请回答下列问题:
(1)若E气体是大气污染物,F是一元强酸。
①写出E→F反应的化学方程式: 。
②现有25℃时0.1 mol·L-1 A的水溶液,若向其中加入等体积0.1 mol·L-1的稀硫酸,则所得溶液中各离子的物质的量浓度由大到小的顺序是 。
③在常温下,向V1 L pH=a的A的水溶液中加入V2 L pH=b的盐酸,且a+b=14,若恰好完全反应,则V1和V2的关系为Vl V2(填“>”、“<”、“=”或“无法确定”),等pH的所得溶液与盐酸比较,由水电离出的c(H+)前者为后者的108倍,则两种溶液的pH= 。
(2)若E气体不是大气污染物,F是二元弱酸。
①B所含元素在周期表中的位置 。
②写出氧化铁与C反应的化学方程式: ;将少量气体E通入氢氧化钙溶液中得不溶物F,F的Ksp=2.8×10-9。现将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp (填“增大”、“减小”或“不变”),此时,组成不溶物F的阴离子在溶液中的浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
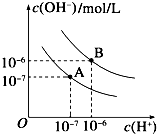
(8分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为 (填A或B)
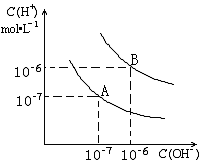 (2)25时,将=9的NaOH溶液与=4的溶
(2)25时,将=9的NaOH溶液与=4的溶
液混合,若所得混合溶液的 =7,则NaOH溶液与
溶液的体积比为
(3)95时,若100体积1=的某强酸溶液与1体积
2=b的某强碱溶液混合后溶液呈中性,则混合前, 与b之间应满足的关系是
查看答案和解析>>
科目:高中化学 来源: 题型:
已知水在25℃和95℃时,其电离平衡曲线如右图所示:
⑴则25![]() 时水的电离平衡曲线应为 (填“A”或“B”)。
时水的电离平衡曲线应为 (填“A”或“B”)。
⑵25![]() 时,将
时,将![]() =8的NaOH溶液与
=8的NaOH溶液与![]() =5的
=5的![]() 溶液
溶液
混合,若所得混合溶液的 ![]() =7,则NaOH溶液与
=7,则NaOH溶液与![]() 溶
溶
液的体积比为 。
⑶95![]() 时,0.1 mol/L的NaOH溶液的pH值是 。
时,0.1 mol/L的NaOH溶液的pH值是 。
⑷95![]() 时,若100体积
时,若100体积![]() 1=
1=![]() 的某强酸溶液与1体积
的某强酸溶液与1体积![]() 2=b的某强碱溶液混合后溶液呈中性,则混合前,
2=b的某强碱溶液混合后溶液呈中性,则混合前,![]() 与b之间应满足的关系是
与b之间应满足的关系是![]() = (用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。
= (用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com