
| A、v(Fe)=0.5 mol?L-1?min-1 |
| B、v(H2SO4)=1 mol?L-1?min-1 |
| C、v(H2)=1 mol?L-1?min-1 |
| D、v(FeSO4)=0.5 mol?L-1?min-1 |
| ||
| △t |
| 5.6g |
| 56g/mol |
| 0.1mol |
| 0.1L |
| 1mol/L |
| 2min |
| 0.1mol |
| 0.1L |
| 1mol/L |
| 2min |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
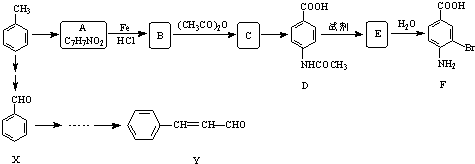
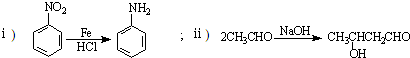
| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.1g | B、3.6g |
| C、7.2g | D、不可求 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、υ(A)=0.5 mol/(L?s) |
| B、υ(B)=0.3 mol/(L?s) |
| C、υ(C)=18 mol/(L?min) |
| D、υ(D)=1 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚氯乙烯都能发生加成反应 |
| B、将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复成原来的红色 |
| C、黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 |
| D、乙烯和苯都使溴水褪色,但褪色的原理不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥⑧ | B、②⑤⑦⑧ |
| C、②⑤⑥⑦ | D、②④⑤⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌片是正极,铜片是负极 |
| B、电子是从锌片通过导线流到铜片上 |
| C、溶液中H+移向锌片被还原变成H2 |
| D、电解液的pH逐渐变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
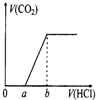 在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )
在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )| A、若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+=HCO3- |
| B、若a:b>l:2,且b=20 mL,则原NaOH溶液的浓度为0.02 mol/L |
| C、若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D、a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com