
| A. | 可以用加热的方法除去Na2CO3固体中的少量NaHCO3固体 | |
| B. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3两种溶液 | |
| C. | 可以用通CO2气体的方法除去NaHCO3溶液中的Na2CO3 | |
| D. | 饱和Na2CO3溶液中通入CO2气体溶液会出现浑浊 |
分析 A.NaHCO3加热易分解,而Na2CO3不能;
B.Na2CO3和NaHCO3两种溶液与石灰水反应均生成碳酸钙白色沉淀;
C.碳酸钠与二氧化碳、水反应生成碳酸氢钠;
D.向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体.
解答 解:A.NaHCO3加热易分解,而Na2CO3不能,则可采用加热的方法除去Na2CO3固体中混有的NaHCO3,故A正确;
B.Na2CO3和NaHCO3两种溶液与石灰水反应均生成碳酸钙白色沉淀,不能鉴别,应选氯化钙,故B错误;
C.碳酸钠与二氧化碳、水反应生成碳酸氢钠,则可向NaHCO3溶液中通入足量CO2气体除去其中混有的Na2CO3,故C正确;
D.向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以最终有晶体析出,故D正确;
故选B.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,易错点为B、C,注意区分二者与碱的反应.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 活化能的大小对化前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ.mol-1,则H2S04(aq)和Ba(0H)2(aq)反应的中 和热△H=2×(-57.3 )kJ•mol-1 | |
| D. | 因 N2(g)+3H2(g)?2NHs(g)△H=-dkJ.mol-1,故在某溶器中投入 l molN2与 3molH2充分反应后,放出热量小于dkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
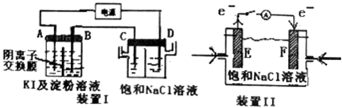 以下装置中,电极材料均为惰性电极.装置Ⅰ中,接通电源,发现A电极附近溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO${\;}_{3}^{-}$+5I-+3H2O.
以下装置中,电极材料均为惰性电极.装置Ⅰ中,接通电源,发现A电极附近溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO${\;}_{3}^{-}$+5I-+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
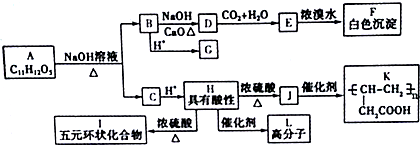
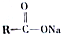 +NaOH$→_{△}^{CuO}$R-H+Na2CO3
+NaOH$→_{△}^{CuO}$R-H+Na2CO3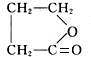 .
.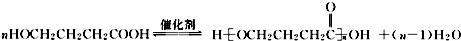 .
.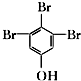 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com