
常温下,在0.01 mol·L-1硫酸溶液中,水电离出的氢离子浓度是( )
A.5×10-13 mol·L-1B.0.02 mol·L-1
C.1×10-7 mol·L-1D.1×10-12 mol·L-1
科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:填空题
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
A.①③B.②④C.①④D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 15盐类水解的原理练习卷(解析版) 题型:选择题
在一定条件下,Na2CO3溶液存在水解平衡:C+H2O HC+OH-。下列说法正确的是( )
HC+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度,减小
D.加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 13pH的计算练习卷(解析版) 题型:填空题
有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测:
(1)该学生的操作是 (填“正确的”或“错误的”),其理由是
(2)若用此方法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是
(3)该学生以上述方式测定下列溶液的pH,无误差的是( )
A.NaOHB.CH3COONaC.NaClD.NaHSO4
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 12水的电离 溶液的酸碱性练习卷(解析版) 题型:填空题
水的电离平衡曲线如图所示:
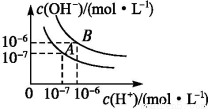
若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 12水的电离 溶液的酸碱性练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.水的电离方程式:H2O H++OH-
H++OH-
B.升高温度,水的电离程度增大
C.在NaOH溶液中没有H+
D.在HCl溶液中没有OH-
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 11弱电解质的电离练习卷(解析版) 题型:选择题
甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1 mol·L-1的甲酸溶液的c(H+)为1×10-2 mol·L-1
B.甲酸能与水以任意比互溶
C.10 mL 1 mol·L-1的甲酸溶液恰好与10 mL 1 mol·L-1的NaOH溶液完全反应
D.滴入石蕊试液显红色
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 模块综合检测练习卷(解析版) 题型:填空题
我们的生活、学习离不开物质,其中很多物质是通过工业生产而得到的。请回答下列问题:
(1)生活用水是来自于自来水公司的管道水,其来源有两个:地表水和地下水。地表水中往往含有悬浮物和胶体,自来水厂需要对地表水进行________处理;地下水中往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行__________处理。
(2)有限的土地,要提高粮食产量,离不开科学技术,离不开化学肥料的合理使用。铵态氮肥中的“铵”的生产原料为________,该物质在工业生产中使用的条件是__________________________________。
(3)患有近视的同学学习离不开眼镜,眼镜片有玻璃和合成树脂的。其中易碎的镜片材料是__________,镜片有灰尘不能用酒精擦拭的是__________。
(4)厨房中离不开食盐,该物质主要来自于海水,写出一种用海水制备食盐的方法____________,工业上可用食盐制备纯碱,食盐的作用是________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3单元综合检测练习卷(解析版) 题型:填空题
钢化玻璃是一类性能良好的玻璃,它可以克服玻璃质脆易碎的缺点。离子交换法是玻璃进行钢化的一种重要方法。将普通的钠钙玻璃在碳酸钾的强化盐(475 ℃)中浸泡3.5小时后即可制得。下图是离子交换法的示意图。

(1)普通玻璃是由石英砂、__________和__________高温熔融而成。
(2)普通玻璃表面产生裂纹后非常容易破碎,清除表面裂纹的物质之一是氢氟酸,写出氢氟酸与玻璃反应的化学方程式________________。
(3)玻璃进行钢化过程中,离子交换是__________(填“物理变化”或“化学变化”)。
(4)在玻璃进行钢化处理时,能否用碳酸氢钾代替碳酸钾,__________(填“能”或“不能”),原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com