
��10�֣�
(һ)˫��ˮ��ˮ���ɿ����Ǽ����ĵ���ʣ���H2O2��H2O��ȣ�H2O2�������ԡ�
��1������H2O2���ɶ�Ԫ���ᣬ��д������ˮ�еĵ��뷽��ʽ ��
��2��ˮ��������H3O+��OH-����ˮ����ż���룬ͬˮһ����H2O2Ҳ�м�������ż���룬����ż����ķ���ʽΪ ��
(��)�±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
�¶�/�� | 25 | t1 | t2 |
Kw/ mol2��L-2 | 1��10-14 | a | 1��10-12 |
�Իش����¼������⣺
��1����25< t1< t2����a 1��10-14���<������>����=�������ɴ��жϵ������ǣ� ��
��2����t1���£�pH=10��NaOH��Һ�У�ˮ���������C(OH-)Ϊ�� ��
��3����t2���£���pH=11�Ŀ�������ҺV1 L��pH=1��������ҺV2 L��ϣ����Ϻ���Һ���Ϊԭ����Һ���֮�ͣ�������Һ��pH=2����V1�UV2 = ��
(һ) ��1��H2O2  H++HO2-�� HO2-
H++HO2-�� HO2-  H++O22- ��2��H2O2+ H2O2
H++O22- ��2��H2O2+ H2O2  H3O2+ + HO2-
H3O2+ + HO2-
��������1���� �¶����ߣ�ˮ�ĵ���̶��������ӻ����� ��2��1��10-10mol/L ��3��9�U11
��������
�����������һ����1������������������ʣ�H2O2��Һ���������ڶ�Ԫ����ֲ����룬����ķ���ʽΪ��H2O2?H++HO2-��HO2-?H++O22-����2��ˮ��������H3O+��OH-����ˮ����ż���룬ͬˮһ����H2O2Ҳ�м�������ż���룬����ż����ķ���ʽ��H2O2+H2O2?H3O2++HO2-����������1��ˮ��������ʣ����ڵ���ƽ�⣬�������ȣ������¶����ߣ�ˮ�ĵ���̶��������ӻ�����2��pH=10��NaOH��Һ�У�����������������ˮ�ĵ��룬��Һ�е���������ˮ���룬ˮ���������[OH-]������Һ��������Ũ�ȣ���[OH-]=[H+]=1��10-10 mol?L-1����3��t2���£�ˮ�����ӻ�Ϊ1��10-12��pH=11�Ŀ�������Һ�������ΪV1����Һ������������Ũ��Ϊ��0.1mol/L��pH=1��������Һ�������ΪV2��������Ũ��Ϊ��0.1mol/L�����û����Һ��pH=2��˵��ϡ���������������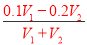 =0.01�����V1��V2=9��11��
=0.01�����V1��V2=9��11��
���㣺���������ˮ��Һ�еĵ���ƽ�⡢��ҺpH�ļ���


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����и߶�10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������Ͻ����������������������ɼ�ʮ���������Ĥ��ij�о���ѧϰС��ģ�ҵ������Ƭ������������������ֱ���ǦƬ����ƬΪ�缫����������ҺΪ���Һ��������ͼ��ʾװ�����ӵ���װ�ã����40 min��ȡ����Ƭ����ˮ��ϴ������ˮ�����з�մ���20��30 min�����ɵõ��������ܵ�����Ĥ�������й�˵����ȷ���� ( )��
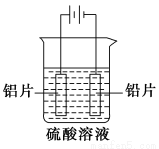
A�����ʱ���Ӵӵ�Դ���������ߡ�������Ǧ�������ߡ���Դ����
B���ڵ������У�H���������ƶ���SO �������ƶ�
�������ƶ�
C��������������Χ��Һ��pH�½�
D�������ܷ�ӦΪ2Al��6H��===2Al3����3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
(1)��һ�������£��ݻ�Ϊ 10L�ܱ������з�����Ӧ��CH4(g)+H2O(g) 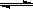 CO(g)+3H2(g)����H>0����1��0 mol CH4��2��0 mol H2O(g)ͨ����ܱ�����10 minʱ��0��1 mol CO���ɣ���10 min�ڸ÷�Ӧ��ƽ�����ʦ�(H2) ��
CO(g)+3H2(g)����H>0����1��0 mol CH4��2��0 mol H2O(g)ͨ����ܱ�����10 minʱ��0��1 mol CO���ɣ���10 min�ڸ÷�Ӧ��ƽ�����ʦ�(H2) ��
��2)��ѹǿΪ0��1 MPa������,�ݻ�ΪV Lij�ܱ�������a mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״��� CO(g)+2H2(g)  CH3OH(g) ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
CH3OH(g) ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
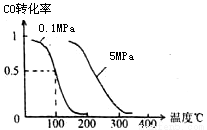
�ٸ÷�Ӧ�ġ�H 0 (�<������>����=��)��
��100��ʱ�÷�Ӧ��ƽ�ⳣ��K= (�ú�a��V�Ĵ���ʽ��ʾ)��
�����¶��ݻ����������£�����ܱ�����������a mol CO�� 2a mol H2���ﵽ��ƽ��ʱ��CO��ת���� (���������С�����䡱)��ƽ�ⳣ�� (���������С�����䡱)
����ij�¶��£���һ���ݻ�������ܱ�������ͨ��2��5mol CO��7��5mol H2��Ӧ����CH3OH(g)���ﵽƽ��ʱCO��ת����Ϊ80%����ʱ�����ڵ�ѹǿΪ��ʼʱ�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�2SO2(g) + O2(g) 
 2SO3(g)��
2SO3(g)��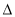 H=��197 kJ/mol������˵����ȷ����
H=��197 kJ/mol������˵����ȷ����
A��ʹ�ô����������SO2��ת����
B������O2��Ũ�ȿ�����߷�Ӧ���ʺ�SO2��ת����
C����Ӧ450��ʱ��ƽ�ⳣ��С��500��ʱ��ƽ�ⳣ��
D������ƽ������ϵѹǿ�� v������v���С��ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Ӧ��A===B + C �������²����Է����У��ڸ��������Է����У��Ը÷�Ӧ���̵��ʱ䣨��H�����ر䣨��S�����ж���ȷ����
A�� ��H��0����S��0
B�� ��H��0����S��0
C�� ��H��0����S��0
D�� ��H��0����S��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ���������ѧУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ѪҺ�ڵ�Ѫ�쵰��(Hb)����O2�������HbO2����˾�������������CO������з�����Ӧ��CO��HbO2 O2��HbCO,37��ʱ���÷�Ӧ��ƽ�ⳣ��K��220.HbCO��Ũ�ȴﵽHbO2Ũ�ȵ�0.02������ʹ���������𣮾ݴˣ����н��۴������
O2��HbCO,37��ʱ���÷�Ӧ��ƽ�ⳣ��K��220.HbCO��Ũ�ȴﵽHbO2Ũ�ȵ�0.02������ʹ���������𣮾ݴˣ����н��۴������
A��CO��HbO2��Ӧ��ƽ�ⳣ��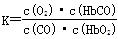
B�����������COԽ�࣬��Ѫ�쵰��ϵ�O2Խ��
C���������CO��O2Ũ��֮�ȴ��ڻ����0.02ʱ���˵������Ż�����
D����CO�ж��IJ��˷����ѹ�����нⶾ����ԭ����ʹ����ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ���������ѧУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ݻ�һ�����ܱ������У����淴Ӧ��A2(g)+ B2(g) xC(g) ��������ͼ����ʾ��ϵ���ɴ��ƶ϶�ͼ�����ȷ˵����
xC(g) ��������ͼ����ʾ��ϵ���ɴ��ƶ϶�ͼ�����ȷ˵����
A��P3<P4��Y���ʾA2��ת����
B��P3<P4��Y���ʾA2��Ũ��
C��P3>P4��Y���ʾ���������ܶ�
D��P3>P4��Y���ʾ��������ƽ��Ħ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭̨����ѧ�߶���ѧ�ڵ�һ��ͳ����ѧ�Ծ��������棩 ���ͣ������
��16 �֣� ��1����ͼ��1 mol NO2��1 mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ�� ��
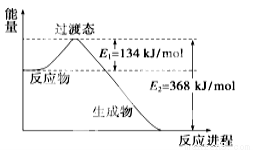
��2��)���ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣
��֪��C(s��ʯī)+O2(g)=CO2(g) ��H1=-394 kJ��mol-1
2H2(g)+O2(g)=2H2O(l) ��H2=-572 kJ��mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)��H3=-2600kJ��mol-1
���ݸ�˹���ɣ�����298Kʱ��C(s��ʯī)��H2(g)����1 mol C2H2 (g)��Ӧ���ʱ䣺
��H=_____ ��
��3�� 4.6 g�ƾ���һ������������ϵ�ȼ��ǡ����ȫȼ�գ�����5.4 gˮ��4.48 L CO2(������ڱ�״���²ⶨ)�����ų�140 kJ������д����ʾ�ƾ�ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
��4���к�����ָ�������кͷ�Ӧ����l mol H2O���ų���������ijѧ����ͨ���ⶨ��Ӧ���������ų������������к��ȡ�����50mL0.5mol/L��������50mL0.55mol/L��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ����ش��������⣺
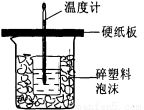
�ٴ�ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��___________���ձ���������������ĭ��������_________ ________��
��ʵ���и���60 mL 0.50 mol/L�������50mL 0.55 mol/L��NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������________(���ȡ�����ȡ�)�������� �����к��ȵ���ֵ��________(���ȡ�����ȡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����۳���ص�һ���и߶��ϵ�һ�ο��Ի�ѧ��B���Ծ��������棩 ���ͣ�ѡ����
pH��ͬ�İ�ˮ��NaOH��Һ���ֱ�������ˮϡ����ԭ�����m����n����ϡ�ͺ�����Һ��pH��Ȼ��ͬ����m��n�Ĺ�ϵ��
A��m��n B��m��n C��m��n D������ȷ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com