

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 结论:该气体具有 |
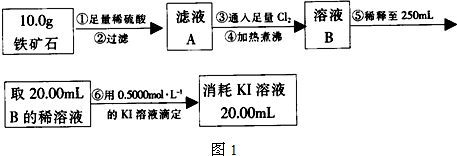
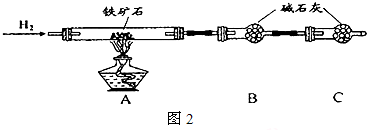
| ||
| 5.0g |
| 0.5mol/L×0.25L×56g/mol |
| 10g |
| 70 |
| 56 |
| 24 |
| 16 |
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | ||
| b | 离子方程式:2OHˉ+SO2=SO32ˉ+H2O | ||
| c | 含淀粉的碘水 | 结论:该气体具有还原性 |


科目:高中化学 来源: 题型:
| A、NaH2PO4的水解:H2PO4-+H2O?H3O++HPO42- |
| B、H2S在水中的电离:H2S?2H++S2- |
| C、Na2SO3的水解:SO32-+H2O?HSO3-+OH- |
| D、CH3COONa在水中的电离:CH3COONa?CH3COO-+Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
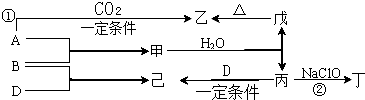
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯、氯仿、己烯、酒精、苯酚水溶液、纯碱 |
| B、五瓶无色溶液:乙醇、乙醛、乙酸、葡萄糖、丙三醇 |
| C、四瓶无色液体:己烯、环己烷、溴乙烷、苯 |
| D、四瓶无色溶液:CCl4、苯乙烯、乙醇、苯酚溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的浓盐酸与MnO2反应 |
| B、过量的Zn与18 mol/L的硫酸反应 |
| C、过量的Fe与稀硝酸反应 |
| D、过量的H2与N2在催化剂存在下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、m+n>p |
| B、C的体积分数增加 |
| C、平衡向正反应方向移动 |
| D、A 的转化率降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com