
工业上制取C1O2的化学反应:2 NaClO3+SO2+H2SO4 ==2C1O2+2 NaHSO4,下列说法正确的是( )
A.SO2在反应中被氧化B.NaC1O3在反应中失去电子
C.H2SO4在反应中作氧化剂 D.1mol还原剂在反应中失去1 mo l电子
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是(双选)( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO- )>c(OH- )
B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH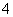 )>c(Cl-)>c(OH- )
)>c(Cl-)>c(OH- )
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合: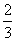 c(Na+)=c(CO
c(Na+)=c(CO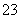 )+c(HCO
)+c(HCO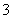 )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸): 2c(C2O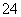 )+c(HC2O
)+c(HC2O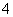 )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明的溶液中含有Cu2+、Mg2+、A13+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、N O3-中的三种离子,若向其中加入石蕊试液,溶液显蓝色;则原溶液中可能存在的离子是 ( )
A.Ba2+、 OH-、NO3- B.Ag+、HCO3-、NO3-
C.Mg2+、A13+、SO42- D.Mg2+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是 ( )
A.CaCO3属于碳酸盐
B.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.蓝矾(CuSO4·5H2O)和干冰属于化合物,铁矿石属于混合物
D.通过化学反应,可由Ba(OH)2一步转化生成NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种物质之间有如下转化关系:
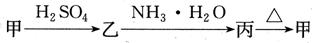
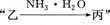 (1)若甲和丙都是不溶于水的白色固体物质,
(1)若甲和丙都是不溶于水的白色固体物质, 既能溶于盐酸又能溶于氢氧化钠溶液。则甲是 ,丙是 (填化学式)。 写出
既能溶于盐酸又能溶于氢氧化钠溶液。则甲是 ,丙是 (填化学式)。 写出
转化的离子方程式:
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲是 , 丙是 。(填化学式)。写出“甲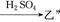 转化的离子方程式: 。
转化的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属离子和硫离子在水溶液中的反应比较复杂,其产物与离子的水解、金属硫化物的溶解度、离子的氧化性或还原性等因素有关。经过查阅资料可知,CuS在水中的溶解度很小,在稀酸溶液中也不溶解;Fe2S3在水中的溶解度更小,但却能溶于稀酸。下列有关说法正确的是( )
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.NH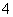 和S2-在水溶液中发生相互促进的水解反应,所以不存在(NH4)2S的水溶液
和S2-在水溶液中发生相互促进的水解反应,所以不存在(NH4)2S的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物只可能是Fe2+、S
D.Fe3+的氧化性比Cu2+的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时冰醋酸加水稀释过程中导电能力的变化如图所示。溶液的导电性体现了溶液中离子浓度大小。一般来说,溶液导电能力越强,离子浓度越大。
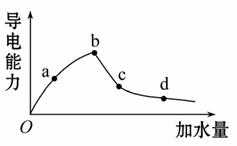
(1)图中O点[H+]=________mol·L-1。
(2)a、b、c、d四点中溶液的[H+]大小顺序为____________。电离程度大小顺序为______。电离平衡常数大小顺序为__________。(用“>”“=”或“<”来表示)
(3)若要使c点溶液中[CH3COO-]增大,而又不产生气体,则下列措施中可选择
_______ _。
_。
A.加水 B.加热
C.加锌粒 D.加固体NaOH
E.加很稀的 NaOH溶液 F.加固体CH3COON
NaOH溶液 F.加固体CH3COON a
a
(4)设d点醋酸溶液的浓度为c mol·L-1,此温度下醋酸的电离常数为Ka mol·L-1,达到平衡时醋酸分子浓度可近似为c mol·L-1,求平衡时溶液的pH(用Ka和c表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
甲醇脱水反应2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________ kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com