
【题目】[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元素 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
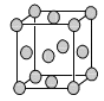
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
【答案】(1)非极性分子,2,分子间形成氢键;(2)4Al(s)+ 3 O2(g) =2Al2O3(s) △H= -3352Kjmol;(3)M,9 ,6,N>O>S;(4)3.61×10-8cm,正四面体结构,sp3,A D。
【解析】
试题分析:T形成自然界硬度最大的单质,即为金刚石,T:C,原子序数依次增大,W与C同周期,核外有一个未成对电子,即W:N,X的电离能第三电离能到第四电离能发生突变,即最外层有三个电子,故X:Al,Y的氧化物形成酸雨的主要物质,即Y:S,Z的质子数=63-34=29,Z:Cu,(1)形成的化合物为CS2,空间构型为直线型,因此属于非极性分子,其结构式为S=C=S,两个成键元素之间只能形成1个σ键,因此CS2中有2个σ键,W的氢化物为NH3,因为存在氢键,所以容易被液化;(2)4Al+3O2=2Al2O3,4molAl燃烧放出的热量为419×4×27/13.5kJ=3352 kJ,即热化学反应方程式为:4Al(s)+3O2(g)=2Al2O3(s) △H=-3352kJ·mol-1;(3)属于第三周期第ⅥA族元素,能层分别为K、L、M,能量离核越远能量越高,最高能层为M,该能层具有的原子轨道数为9,电子数为6,同一周期从左向右第一电离能增大,ⅡA>ⅢA,ⅤA>ⅥA,同主族从上到下,第一电离能减小,即顺序是N>O>S;(4)利用均摊法晶胞中含有铜原子的个数为8×1/8+6×1/2=4,因此此晶胞的质量4×64/NAg,根据密度的定义式,9=4×64/(NA×a3),a=3.61×10-8cm,SO42-中含有4个σ键,孤电子对数=1/2×(6+2-4×2)=0,因此价层电子对数为4,属于正四面体结构,杂化轨道数=价层电子对数=4,即S的杂化类型为sp3,A、根据化合价的变化,O2的化合价降低,作氧化剂,故正确;B、HO2属于还原产物,故错误;C、HO2属于一种弱酸,在碱性中发生中和反应,因此不能存在碱性溶液中,故错误;D、CuCl中Cu显+1价,因此1molCu参加反应有1mol电子失去,故正确。


科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P 的叙述正确的是( )
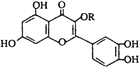
A. 若R为甲基则该物质的分子式可以表示为C16H10O7
B. 该物质中最多有7个碳原子共平面
C. 1mol该化合物与浓溴水反应,最多可与5mol Br2完全反应
D. 若R为饱和烃基,1mol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100 mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1 mol·L-1 盐酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是

A. 水样中一定不存在Fe3+、Cu2+,可能存在Ag+
B. 水样中一定存在CO32-、SO42-、Cl-
C. BC段曲线所表示的离子方程式为CO32-+2H+=H2O+CO2↑
D. 水样中一定存在K+,且c(K+)≥0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中c(Cl-)最大的是
A. 65mL1mol/L的KCl溶液 B. 25mL3mol/L的NaCl溶液
C. 20mL2mol/L的MgCl2溶液 D. 10mL1.5mol/L的AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4· H 2O(三盐),主要制备流程如下。

(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为_________。若铅蓄电池放电前正、负极质量相等,放电时转移了lmol电子,则理论上两极质量之差为___________。
2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为_________。若铅蓄电池放电前正、负极质量相等,放电时转移了lmol电子,则理论上两极质量之差为___________。
(2)将滤液I、滤液III合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物( Mr=322) ,其化学式为______________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO的离子方程式为_____________;滤液II中溶质的主要成分为________(填化学式)。
(4)步骤⑥合成三盐的化学方程式为____________ 。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,正确的是
A. 浓硝酸保存在无色玻璃试剂瓶中
B. 少量的钠保存在水中
C. 氢氧化钠溶液保存在具磨口玻璃塞的试剂瓶中
D. FeSO4溶液存放在加有少量铁粉的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种金属,A中混有C时A先腐蚀,A与B组成原电池,A为电池正极,则A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用的KNO3的性质是
A. 自燃性 B. 易分解 C. 还原性 D. 氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L0.1mol.L-1的K2SO4溶液中
A.K+的物质的量为0.1 mol B.SO42-的物质的量为0.2mol
C.K+的物质的量浓度为0. 1mol.L-1 D. SO42-的物质的量浓度为0. 1mol.L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com