

分析 (1)①加水稀释促进醋酸电离,导致稀释后的溶液中氢离子浓度大于原来的百分之一;
②醋酸是弱电解质,在水溶液里部分电离导致溶液中氢离子浓度小于酸浓度;
③醋酸钠是强碱弱酸盐,溶液呈碱性;
(2)①K=$\frac{[C{H}_{3}OH]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]^{3}}$;
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,温度越高,化学平衡常数越小.
解答 解:(1)①加水稀释促进醋酸电离,导致稀释后的溶液中氢离子浓度大于原来的百分之一,所以稀释100倍后所得溶液的pH<a+2,故答案为:<;
②醋酸是弱电解质,在水溶液里部分电离导致溶液中氢离子浓度小于酸浓度,所以溶液呈氢离子浓度小于0.01mol/L,则pH>2,故答案为:>;
③醋酸钠是强碱弱酸盐,醋酸根离子水解导致其溶液呈碱性,则pH>7,故答案为:>;
(2)①K=$\frac{[C{H}_{3}OH]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]^{3}}$,故答案为:$\frac{[C{H}_{3}OH]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]^{3}}$;
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,故答案为:>.
点评 本题考查了化学平衡常数的含义及弱电解质的电离,明确弱电解质电离特点及化学平衡移动影响因素即可解答,(2)②中要根据II、I两条曲线变化确定温度高低,从而确定化学平衡常数,为解答难点.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  称取NaOH固体 | B. | 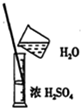 稀释浓硫酸 | ||
| C. | 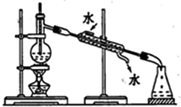 分离乙醇和水混合物 | D. | 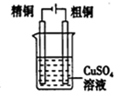 电解炼制铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的同分异构体中,一氯代物仅有一种的有机物一定是2,2一二甲基戊烷. | |
| B. | 若某高分子化合物对应的单体有两种,则此高聚物一定是通过缩聚反应得到的. | |
| C. | 等物质的量的乙烯和乙醇在足量氧气中完全燃烧,消耗O2和生成CO2的量相等 | |
| D. | 苯丙氨酸的结构为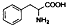 ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com