
【题目】按要求答题:
(1)向偏铝酸钠溶液中通入足量的CO2离子反应方程式____________;
(2)铝与氢氧化钠溶液化学反应方程式_____________;
(3)将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体化学反应方程式_________;
(4)向Al2(SO4)3溶液中滴加氨水制备氢氧化铝的离子反应方程式________;
【答案】AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- 2Al+2NaOH+2H2O=2 NaAlO2+3H2↑ FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl Al3++3NH3·H2O=Al(OH)3↓+3NH4+
Fe(OH)3(胶体)+3HCl Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
(1)向偏铝酸钠溶液中通入足量的CO2生成Al(OH)3沉淀和碳酸氢钠,离子反应方程式AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(2)铝与氢氧化钠溶液生成NaAlO2和H2,化学反应方程式2Al+2NaOH+2H2O=2 NaAlO2+3H2↑;故答案为:2Al+2NaOH+2H2O=2 NaAlO2+3H2↑;
(3)利用水解法制备氢氧化铁胶体,将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,同时水解生成HCl,化学反应方程式FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;故答案为:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl;故答案为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(4)NH3·H2O是弱电解质,向Al2(SO4)3溶液中滴加氨水制备氢氧化铝和硫酸铵,离子反应方程式Al3++3NH3·H2O= Al(OH)3↓+3NH4+;故答案为:Al3++3NH3·H2O= Al(OH)3↓+3NH4+。


科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
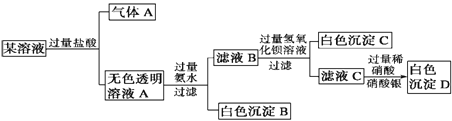
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。

(1)装置A制取氯气,该反应的化学方程式:___________。
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:___________。
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量___________溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是___________。
③丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
④丙同学取溶液X于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是_________(填选项序号)。
a. BaCl2溶液 b. Ba(OH)2溶液 c. 氯水 d. 石蕊溶液
SO2与Cl2同时通入水中反应的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是( )

A.CH3COOH溶液中滴加KOH溶液
B.NaOH溶液中滴加稀HCl
C.Ba(OH)2溶液中滴加稀H2SO4
D.Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
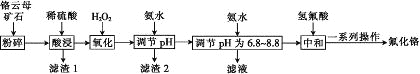
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2. N2的电子式为____________,该反应的方程式为___________________________________________
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为_________________(已知该反应为置换反应)
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为______,K的原子结构示意图为_______________________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)配制时必需的玻璃仪器有:________________;
(2)在配置过程中,下列操作不正确的是(填序号)__________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解.
D.将准确量取的浓硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好.
(4)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”下同),②未经冷却趁热将溶液注入容量瓶中,_______,③容量瓶中原有少量蒸馏水,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
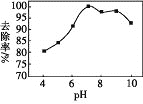
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别为生物体内分子的部分结构模式图,请据图回答问题:

(1)甲图中的三种物质分别属于动物、植物细胞中的储能物质的是_____,组成这三种物质的单体都是_____。
(2)乙图所示化合物的基本组成单位是___________,即图中字母_______________ 所示的结构表示,各基本单位之间是通过_____________(填“①”“②”或“③”)连接起来 的。
(3)丙图是由________个氨基酸经__________ 过程形成的,氨基酸的结构通式为__________ 。检验丙和戊可以用______________ 试剂。
(4)丁和戊中的 Mg2+、Fe2+体现了无机盐具有什么功能?_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com