
分析 (1)结合物质的量浓度和溶质质量分数换算关系计算得到,若食盐水中SO42-沉淀完全结合溶度积常数计算溶液中c(Ba2+);
(2)铁离子和铝离子水解溶液显酸性,生成氢氧化铁、氢氧化铝沉淀;
(3)n(BaCl2)=0.060 0 mol•L-1×20.00×10-3 L=1.2×10-3 mol,
V(EDTA)=(23.82+23.79+23.79)/3=23.80 mL,
与EDTA反应的n(BaCl2)=n(EDTA)=0.050 0 mol•L-1×23.80×10-3 L=1.19×10-3 mol,
n(Na2SO4)=n(BaCl2)=1.2×10-3 mol-1.19×10-3 mol=1.0×10-5 mol.
解答 解:(1)溶质质量分数为36.5%的浓盐酸密度为1.18g•mL-1,该浓盐酸的物质的量浓度c=$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8 mol•L-1,
已知:室温下,Ksp(BaSO4)=1.0×10-10.若食盐水中SO42-沉淀完全(浓度小于1×10-6 mol•L-1),则溶液中c(Ba2+)=$\frac{Ksp}{c(S{{O}_{4}}^{2-})}$=$\frac{1.0×1{0}^{-10}}{1×1{0}^{-6}}$mol/L=1.0×10-4 mol•L-1,
故答案为:11.8 mol•L-1;1.0×10-4 mol•L-1;
(2)加入浓盐酸使溶液呈酸性的原因是防止Fe3+、Al3+水解(不与三乙醇胺反应),
故答案为:防止Fe3+、Al3+水解(不与三乙醇胺反应);
(3)n(BaCl2)=0.060 0 mol•L-1×20.00×10-3 L=1.2×10-3 mol,
V(EDTA)=(23.82+23.79+23.79)/3=23.80 mL,
与EDTA反应的n(BaCl2)=n(EDTA)=0.050 0 mol•L-1×23.80×10-3 L=1.19×10-3 mol,
n(Na2SO4)=n(BaCl2)=1.2×10-3 mol-1.19×10-3 mol=1.0×10-5 mol,
盐水中Na2SO4的浓度=$\frac{1.0×1{0}^{-5}mol×142g/mol}{10×1{0}^{-3}L}$×5=0.71 g•L-1,
答:通过计算确定原食盐水中Na2SO4的浓度为0.71 g•L-1.
点评 本题考查了浓度换算、滴定实验过程分析判断、定城镇定量关系的计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示.下列说法正确的是( )
常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | 曲线Ⅱ表示氨水加水稀释过程中溶液导电性的变化 | |
| B. | 溶液的pH大小关系:c>b>d | |
| C. | 由水电离出的n(OH- ):b>c | |
| D. | 若将b、d两点溶液混合,则:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
 ,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是以烃A为原料经过一系列反应合成的:
)是以烃A为原料经过一系列反应合成的:

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O.
+2NaCl+2H2O. +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
在含c(NH4Cl)=3c(AlCl3)的溶液中滴加稀NaOH溶液。下列离子方程式不符合实际情况的是( )
A.Al3++3NH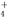 +6OH-===Al(OH)3↓+3NH3·H2O
+6OH-===Al(OH)3↓+3NH3·H2O
B.2Al3++NH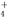 +7OH-===2Al(OH)3↓+NH3·H2O
+7OH-===2Al(OH)3↓+NH3·H2O
C.Al3++3NH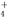 +7OH-===AlO
+7OH-===AlO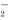 +3NH3·H2O+2H2O
+3NH3·H2O+2H2O
D.Al3++5NH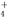 +9OH-===5NH3·H2O+AlO
+9OH-===5NH3·H2O+AlO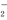 +7H2O
+7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com