
【题目】求下列溶液的pH(常温条件下)(已知lg2=0.3)
(1)0.005 mol·L-1的H2SO4溶液________
(2)已知CH3COOH的电离常数Ka=1.8×10-5,0.1 mol·L-1的CH3COOH溶液________
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=![]() ×100%)________
×100%)________
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合________
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合________
(6)将pH=3的HCl与pH=3的H2SO4等体积混合________
(7)0.001 mol·L-1的NaOH溶液________
(8)pH=2的盐酸与等体积的水混合________
(9)pH=2的盐酸加水稀释到1 000倍________
【答案】2 2.9 11 9.7 6 3 11 2.3 5
【解析】
(1)根据硫酸化学式可知c(H+)与硫酸浓度的关系,根据pH=-lg[c(H+)]计算该溶液的pH;
(2)根据醋酸的电离平衡常数等于醋酸根离子浓度和氢离子浓度乘积与醋酸浓度的比值来计算;
(3)根据电离度计算出0.1mol.L-1的NH3H2O溶液中氢氧根离子浓度,然后计算出其pH;
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合,先计算出混合液中氢氧根离子浓度,然后计算出氢离子浓度及溶液的pH;
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11:9混合,酸过量,计算出混合液中氢离子浓度,再计算出混合液的pH;
(6)将pH=3的HCl与pH=3的H2SO4等体积混合,混合液的pH不变;
(7)0.001molL-1的NaOH溶液,先计算出溶液中氢离子浓度,再计算出溶液的pH;
(8)pH=2的盐酸与等体积的水混合,先根据溶液的稀释原理计算出氢离子浓度,再计算出溶液的pH;
(9)pH=2的盐酸加水稀释到1000倍,先计算出稀释后溶液中氢离子浓度,再计算出溶液的pH。
(1)该硫酸溶液中氢离子浓度为:c(H+)=2c(H2SO4)=2×0.005mol/L=0.01mol/L,
该硫酸溶液的pH为:pH=lg[c(H+)]=lg0.01=2,
故答案为:2;
(2)0.1mol.L1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5),醋酸根离子和氢离子浓度相等,由于电离程度小,CH3COOH的浓度近似为0.1mol/L,所以c(H+)=![]() mol/L=1.34×103mol/L,所以pH=lg(1.34×103)≈2.9,
mol/L=1.34×103mol/L,所以pH=lg(1.34×103)≈2.9,
故答案为:2.9;
(3)0.1mol.L1的NH3H2O溶液,NH3H2O的电离度为α=1%,则该氨水溶液中氢氧根离子浓度为:0.1mol/L×1%=1×103mol/L,则该溶液的pH=11,
故答案为:11;
(4)将pH=8的NaOH溶液中氢氧根离子浓度为:1×106mol/L,pH=10的NaOH溶液中氢氧根离子浓度为:1×104mol/L,两溶液等体积混合后溶液中氢氧根离子浓度为:![]() ×(1×106mol/L+1×104mol/L)≈5×105mol/L,混合液中氢离子浓度为:c(H+)=
×(1×106mol/L+1×104mol/L)≈5×105mol/L,混合液中氢离子浓度为:c(H+)=![]() =2×1010mol/L,则混合液的pH═lg[c(H+)]=10lg2=9.7,
=2×1010mol/L,则混合液的pH═lg[c(H+)]=10lg2=9.7,
故答案为:9.7;
(5)常温下,将pH=5的盐酸中氢离子浓度为:1×105mol/L,pH=9的NaOH溶液中氢氧根离子浓度为:1×105mol/L,以体积比11:9混合后盐酸过量,溶液显酸性,混合液中氢离子浓度为:c(H+)=![]() mol/L=1×106mol/L,混合液的pH=6,
mol/L=1×106mol/L,混合液的pH=6,
故答案为:pH=6;
(6)将pH=3的HCl中氢离子浓度为0.001mol/L,pH=3的H2SO4中氢离子浓度为0.001mol/L,等体积混合后,混合液中氢离子浓度仍然为0.001mol/L,溶液的pH=3,
故答案为:3;
(7)0.001molL1的NaOH溶液中氢离子浓度为:1×1011mol/L,该溶液的pH=11,
故答案为:11;
(8)pH=2的盐酸中氢离子浓度为0.01mol/L,与等体积的水混合后氢离子浓度为0.005mol/L,混合液的pH=3lg5=3(1lg2)=2.3,
故答案为:2.3;
(9)pH=2的盐酸中氢离子浓度为0.01mol/L,加水稀释到1000倍后氢离子浓度为:1×105mol/L,该溶液的pH=5,
故答案为:5。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4 mol A气体和4 mol B气体混合放入2 L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g)![]() C(g)+2D(g);经5min达到平衡, 测得体系中C的体积分数为1/9 ,下列说法中正确的是( )
C(g)+2D(g);经5min达到平衡, 测得体系中C的体积分数为1/9 ,下列说法中正确的是( )
A.D的平均速率为0.32mol/(L·min)
B.B的转化率为40%
C.增加B,B的平衡转化率升高
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
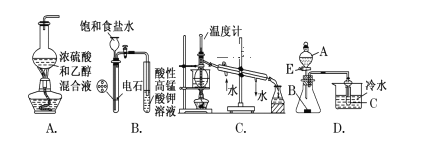
A.装置A:实验室制乙烯
B.装置B:实验室制乙炔并验证乙炔能发生氧化反应
C.装置C:实验室中分馏石油
D.装置D:若 A 为醋酸,B 为贝壳(粉状),C 为苯酚钠溶液,可验证醋酸酸性强于碳酸,但不能验证碳酸酸性强于苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,现在向0.001 mol·L-1K2CrO4和0.01 mol·L-1KCl混合液中滴加0.01 mol·L-1AgNO3溶液,通过计算回答:
(1)Cl-、CrO42-谁先沉淀________?
(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是________?(设混合溶液在反应中体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
B. HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
C. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D. 一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究![]() 反应的速率影响因素,设计了以下实验。下列说法正确的是
反应的速率影响因素,设计了以下实验。下列说法正确的是
锥形瓶标号 |
| 蒸馏水 |
| 反应温度 | 浑浊出现时间 | 备注 |
1 |
| 0 mL | 10 mL |
| 10s | |
2 | 10mL | 5mL | 5 mL |
| 16 s | |
3 | 10mL | 0mL | 10 mL |
| 5 s | 第10s开始浑浊不再增多 |
4 | 10mL | 4mL |
| 8s |
A.该反应也可通过测![]() 的体积变化来表示化学反应速率的快慢
的体积变化来表示化学反应速率的快慢
B.3号瓶用![]() 来表示速率为
来表示速率为![]()
C.由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D.由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~4min的平均反应速率:v(H2O2)>3.3×10-2mol·L-1·min-1
C.反应至6 min时,H2O2分解了50%
D.反应至6 min时,c(H2O2)=0.25 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com