
【题目】NH3具有广泛的用途。实验室常用如图所示装置制取并收集NH3。

(1)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为______。
(2)干燥NH3应选用的干燥剂是______。
(3)图1中方框内收集NH3的装置可选用图2中的______(填序号)。
(4)尾气处理装置中使用倒置漏斗的作用是______。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 碱石灰 ② 防止倒吸
CaCl2+2NH3↑+2H2O 碱石灰 ② 防止倒吸
【解析】
实验室常用Ca(OH)2和NH4Cl固体受热制备氨气,因为氨气的密度小于空气,因此采用向下排空气法收集,NH3有毒,必须尾气处理,一般是通入到水中,利用NH3极易溶于水,注意防倒吸;
(1)实验室用熟石灰和氯化铵固体混合加热制取NH3,其方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气是碱性气体,干燥氨气常选用的干燥剂为碱石灰;
(3)氨气的密度小于空气的密度,采用向下排空气法收集,即②;
(4)氨气有毒,为防止污染空气,必须进行尾气处理,因为氨气极易溶于水,因此倒置漏斗的作用是防止倒吸。


科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值。则下列有关叙述正确的共有
A.1.4g乙烯与丙烯的混合气体含有NA个碳原子
B.精炼铜,若阳极失去2NA个电子,则阴极增重64g
C.在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA
D.将1L 2mol/L的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向![]() 和
和![]() 的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量
的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量![]() 与加入氢氧化钠溶液的体积
与加入氢氧化钠溶液的体积![]() 关系如图所示.则下列说法正确的是
关系如图所示.则下列说法正确的是
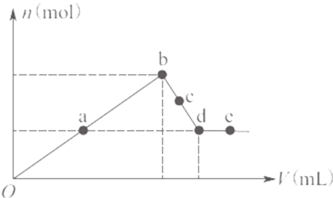
A.ab之间、c两点沉淀物成分相同,d、e两点沉淀物成分相同
B.在反应过程中,各状态点溶液的pH大小顺序是:![]()
C.![]() 段与
段与![]() 段溶液中阴离子的物质的量相等
段溶液中阴离子的物质的量相等
D.在d点,向溶液中逐滴加入盐酸,沉淀量将减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是
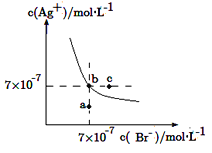
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A 、 B 、 C 、 D 、 E 、 F 六种元素,已知:
① 它们位于三个不同的短周期,核电荷数依次增大。
②E元素的电离能数据见下表(KJ/mol):
![]()
③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:_______________________________
(2)B2A2 分子中存在______________ 个![]() 键,_____________个
键,_____________个![]() 键。
键。
(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键 | F—D | F—F | B—B | F—B | B=D | D=D |
键能(KJ/mol) | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
试计算1molF单质完全燃烧时的反应热△H=________(已知1molF单质中含2mol F—F键,1molFO2中含有4mol键F—O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知![]() 时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
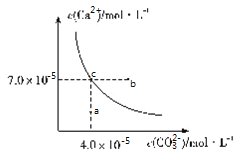
A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应![]() 的平衡常数K=3500
的平衡常数K=3500
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用稀硝酸和铜反应制NO,发现化学反应速率较慢,因此改用浓硝酸按下图所示装置制取NO。
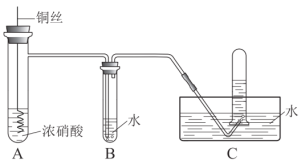
(1)浓硝酸一般盛放在棕色试剂瓶中,原因是______。
(2)Cu与浓硝酸反应的化学方程式是______,其中硝酸体现酸性和______性。
(3)B中反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5mol﹒L-1的碳酸钠溶液1000mL。回答下列问题
(1)需要称量碳酸钠晶体的质量为___________g,所选用容量瓶的规格为___________ mL。
(2)洗涤操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是__________________________________。
(3)定容的正确操作是继续加蒸馏水至离刻度线下1~2cm时,改用_________加水至液面与刻度线相切。
(4)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是__________(填字母)。
a.重新配制
b.吸出多余液体,使凹液面与刻度线相切
c.经计算加入一定量的碳酸钠晶体
d.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
(5)配制时下列操作会导致所配溶液浓度偏高的是_____________(填字母)。
a.转传移时有少量溶液溅出
b.定容时俯视读取刻度
c.容量瓶用蒸馏水洗净后未干燥
d.定容时液面超过了刻度线
(6)从上述配制的溶液中取出10mL,其中含Na2CO3的质量是_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验同中和滴定类似,现用 0.01 mol/L 酸性 KMnO4 溶液滴定 V1mL 未知浓度的无色 Na2SO3溶液,回答下列问题:
(1)该滴定实验中使用的仪器除铁架台、滴定管夹、烧杯外,还需用下列中的___________________________(填序号)。
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.胶头滴管 F.漏斗
(2)反应的离子方程式为 ____________________________。
(3)滴定过程中是否需要指示剂 _____________________________(填“是”或“否”)?请说明理由 ____________________。
(4)滴定前平视 KMnO4 溶液的液面,刻度为 x mL,滴定后俯视液面,刻度为 y mL,则(y-x) mL 比实际消耗 KMnO4溶液体积 ____________________________(填“偏多”或“偏少”)。
(5)滴定终点的现象为 _____________________________。
(6)滴定终点消耗 0.01 mol/L 酸性 KMnO4 溶液体积为 V2mL ,则 Na2SO3 溶液的浓度为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com