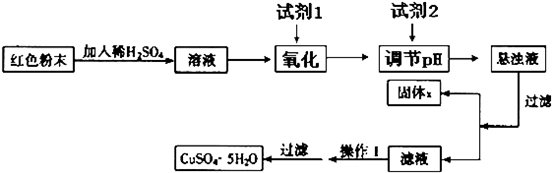
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO��g��+2H
2��g��?CH
3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H
2��һ������CO��CO��CH
3OH��g����Ũ����ʱ��仯��
��ش��������⣺
��1���ڡ�ͼ1���У�����
���a��b����ʾʹ���˴������÷�Ӧ����
��Ӧ��
��2������˵����ȷ����
��
A����ʼ�����COΪ2mol B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵ�ƽ��״̬ D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1molCO��2molH
2���ٴδﵽƽ��ʱ��n��CH
3OH��/n��CO�����С
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��H
2��=
�����¶���CO��g��+2H
2��g��?CH
3OH��g���Ļ�ѧƽ�ⳣ��ֵΪ
�������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ��
�����������С�����䡱����
��4�����ڡ�ͼ3���л���ƽ��ʱ�״��ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P
1��P
2����P
1��P
2����
��5����һ��״����ӽ���Ĥȼ�ϵ�أ��轫�״�����ת��Ϊ���������ַ�Ӧԭ����
A��CH
3OH��g��+H
2O��g��=CO
2��g��+3H
2��g������H=+49.0kJ/mol
B��CH
3OH��g��+
O
2��g��=CO
2��g��+2H
2O��g������H=-192.9kJ/mol
��֪H
2O��l��=H
2O��g����H=+44kJ/mol�����32g��CH
3OH��g����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ
��


 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
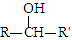 ��R��R���ʾ������
��R��R���ʾ������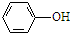
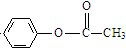
 ��1�����÷�Ӧ6NO2+8NH3
��1�����÷�Ӧ6NO2+8NH3