
| A. | $\frac{m+n+2}{w}$mol | B. | $\frac{m-n+2}{m}$ mol | C. | $\frac{m+n-2}{m}$ mol | D. | $\frac{W(m-n-2)}{m}$mol |
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器内A、B、C三者共存 | B. | vC=vB | ||
| C. | 容器内压强不再变化 | D. | 气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.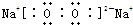 ,EB4
,EB4 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2跟氢气反应的激烈程度逐渐减小 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减小 | |
| C. | F-、Cl-、Br-、I-的还原性依次增强 | |
| D. | HF、HCl、HBr、HI水溶液的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
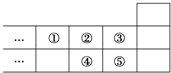
| A. | 元素①位于第2周期第ⅣA族 | |
| B. | ①的气态氢化物与⑤的气态氢化物反应产生白烟 | |
| C. | 元素的氧化物对应水化物的酸性一定是:⑤>④ | |
| D. | 元素的最高正化合价:③=⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
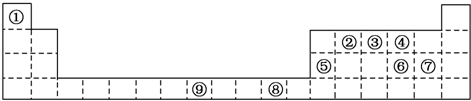
查看答案和解析>>
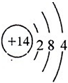
科目:高中化学 来源: 题型:选择题
| A. | 氯离子的结构示意图: | |
| B. | CCl4的电子式: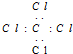 | |
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| D. | 用电子式表示氯化氢分子的形成过程:H+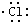 → → |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol•L-1•s-1 | B. | vB=0.3 mol•L-1•s-1 | ||
| C. | vC=0.8 mol•L-1•s-1 | D. | vD=1.0 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com