
【题目】已知反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H <0。请回答下列问题:
2SO3(g) △H <0。请回答下列问题:
(1)某温度下,在一固定体积为2升的密闭容器中,充入2molSO2和lmolO2发生上述反应,当反应进行到2分钟末时达到平衡,平衡混合物中SO3的质量分数为50%,则反应前2分钟内用SO2表示的平均反应速率为_____,SO2的转化率为____,此时反应的平衡常数为_________。
(2)在某恒温、恒压容器中,按体积比2: 1加入SO2和O2进行上述反应,达到平衡后,再向容器中充入适量SO3(g),达到新平衡时,c(O2)将比原平衡_____(填“增大”、“减小”、或“不变”)
(3)若在某恒温、恒容容器中,加入一定量SO3(g)发生上述反应,达到平衡后,再向容器 中充入适量SO3(g),达到新平衡时,c(SO2)/c(SO3)将比原平衡______(填“增大”、“减小”、或“不变”)。
【答案】0.25molL-1min-1 50% 4 不变 减小
【解析】
(1)结合化学平衡的三段式计算平衡状态下个物质的平衡浓度,结合平均反应速率、转化率和平衡常数计算得到;
(2)根据恒温恒压条件下的等效平衡分析判断;
(3)先根据恒温恒压条件下的等效平衡分析,恒容条件下相对于原平衡,等效于加压,平衡向右移动,以此判断。
(1)在一固定体积为2升的密闭容器中,充入2molSO2和lmolO2发生2SO2(g)+O2(g) ![]() 2SO3(g)反应,设当反应进行到2分钟末达到平衡时,消耗氧气的物质的量为x,进行如下计算:
2SO3(g)反应,设当反应进行到2分钟末达到平衡时,消耗氧气的物质的量为x,进行如下计算:
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
起始量(mol)2 1 0
变化量(mol)2x x 2x
平衡量(mol)2-2x 1-x 2x
根据平衡混合物中SO3的质量分数为50%,则![]() 100%=50%,解得x=0.5mol;
100%=50%,解得x=0.5mol;
则反应前2分钟内用SO2表示的平均反应速率为![]() =0.25molL-1min-1;
=0.25molL-1min-1;
SO2的转化率为![]() 100%=50%;
100%=50%;
达到平衡时各物质的浓度分别为:c(SO2)=![]() =0.5mol/L,c(O2)=
=0.5mol/L,c(O2)=![]() =0.25mol/L,c(SO3)=
=0.25mol/L,c(SO3)=![]() =0.5mol/L,此时反应的平衡常数为
=0.5mol/L,此时反应的平衡常数为![]() =4;
=4;
因此,本题正确答案为:0.25molL-1min-1 ;50% ;4;
(2)保持恒温、恒压,反应达到平衡后,再向容器中充入适量SO3(g),在恒压条件下,与原平衡状态相同,是等效平衡,各物质的百分含量不变,所以c(O2)与原平衡相比,应该为不变;
因此,本题正确答案为:不变;
(3)恒温、恒容条件下达到平衡,达到平衡后,再向容器中充入适量SO3(g),恒容条件下相对于原平衡,等效于加压,平衡向右移动,c(SO3)增大,c(SO2)减小,c(SO2)/c(SO3)将比原平衡减小。
因此,本题正确答案为:减小。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:


为了研究X的结构,将化合物A在一定条件下水解只得到B(结构如图所示)和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应 C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________C______________ E _______________
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)反应①_____________________;反应⑥_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
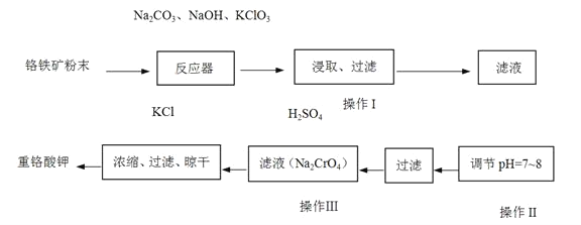
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述正确的是( )
①用稀盐酸洗涤盛放过石灰水的试剂瓶
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③有六种分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阳离子的溶液,不能用NaOH溶液鉴别;
④用稀硝酸清洗做附着在试管表面的Ag单质;
⑤如果皮肤上不慎沾有浓硫酸,应立即用大量的NaOH稀溶液冲洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧某溶液加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,则原溶液中含NH4+。
A.①⑤⑦B.③④⑦⑧C.①②④⑧D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二,而云南钼的产量又居中国首位。钼及其合金在冶金、农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1:1,完成下列方程式:_____Mo+_____HF+_____HNO3=_____MoO2F2+_____MoOF4+_____NO2↑+__________
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②MoS2(s)+2O2(g)═Mo(s)+2SO2(g)△H2
③2MoS2(s)+7O2(g)═2MoO3(s)+4SO2(g)△H3
则ΔH3=_____(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_________mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理为以下所示化学方程式MoS2(s)+4H2(g)+2Na2CO3(s)═Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H
实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH_____0(填“>”或“<”);P2_____0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是_____选填编号)
A.V正(H2)=V逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达到平衡状态
D.容器内压强不变时,一定达到平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=_____(MPa)2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用下图装置进行实验,试回答下列问题:
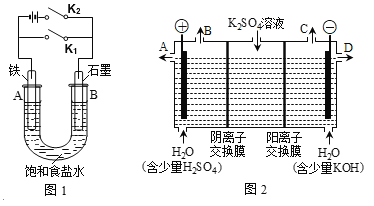
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为__________(填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
①U型管里总反应的离子方程式为____________________。
②对于上述实验,下列说法正确的是_________(填序号)。
A.溶液中Na+向B极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目约为0.2NA
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为___________________。单位时间内通过阴离子交换膜的离子数______(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②从出口D导出的溶液是____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
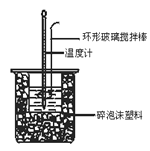
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年2月18日,FDA批准ChelseaTherapeutics公司的Northera胶囊(屈昔多巴)用于治疗神经源性体位性低血压。下列有关该药物的说法不正确的是( )

A.微溶于水,能溶于稀盐酸,也能溶于氢氧化纳溶液
B.既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C.有手性碳原子
D.1H-NMR谱显示9种不同化学环境的氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com