
【题目】下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是

A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:W<Z<X<Y
C. Z的最高价氧化物的水化物可能为强碱
D. W的最高正化合价与负化合价的绝对值可能相等
【答案】D
【解析】
由周期表的相对位置可知, X、Y、Z、W对应的元素有3种可能:C、N、Al、Si;N、O、Si、P;O、F、P、S。
A项、同一周期从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径:Z>W>X>Y,故A错误;
B项、由周期表的相对位置可知,元素的非金属性强弱顺序为Y>X>W>Z,则气态氢化物的稳定性顺序为Y>X>W>Z,故B错误;
C项、若Z为Al元素,则最高价氧化物的水化物为两性氢氧化物,若Z为Si、P,则最高价氧化物的水化物为酸,故C错误;
D项、此图为元素周期表中短周期的一部分,若W为Si元素,Si元素的最高正化合价与负化合价的绝对值相等,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】氮化俚(Li3N)是一种金属化合物,常用作储氢材料,某化学兴趣小组设计制备氮化锂并测定其组成的实验如下(已知:Li3N易水解)。

请回答下列问题:
(1)Li3N水解的化学方程式为__________________。
(2)实验时首先点燃A处酒精灯。写出装置A中发生反应的化学方程式______________。
(3))装置D的作用是_______________。
(4)请用化学方法确定氮化锂中含有未反应的锂,写出实验操作及现象______________。
(5)测定氮化锂的纯度。
假设锂粉只与氮气反应。称取6.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入200.00mL1.00mol/L盐酸中,充分反应后,将所得溶液稀释至500.00mL;取25.00mL稀释后的溶液注入锥形瓶中,加入几滴酚酞,用0.10mol/LNaOH标准溶液滴定过量的盐酸。
①判断滴定终点的现象是___________。
②滴定起始和终点的液面位置如图,则产品的纯度为___________。

③若漓定前平视读数,滴定后仰视读数,则测定结果____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验)
实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。
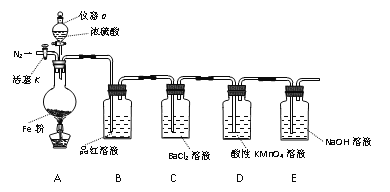
请回答下列问题:
(1)仪器a的名称是____。实验开始前,先通一段时间N2的目的是____。
(2)加热一段时间后发现B装置中溶液褪色,说明有____(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是____。
(3)C装置中____(填“有”或“无”)沉淀生成。D中溶液紫色褪去,体现气体产物的____性(填“氧化”、“还原”或“漂白性”)。
(4)E装置的作用是____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1)A的名称是_________;C的官能团的名称是_________。
(2)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_________ .
(3)E分子中含有两个酯基,且为顺式结构,E的结构简式为_________ .
(4)反应①的化学方程式为_________ 。
(5)试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6)已知:  。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成
。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成![]() 。将以下合成路线补充完整:_________________
。将以下合成路线补充完整:_________________

(7)已知氨基(-NH2)与羟基类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在反应:A(g)+3B(g)![]() 2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断正确的是
A. 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B. 图Ⅱ研究的是温度对反应的影响,且甲的温度较高
C. 图Ⅱ研究的是压强对反应的影响,且甲的压强较大
D. 图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于_______(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为_________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为___________,其所含化学键有__________,乙醇分子中C原子的杂化轨道类型为____________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(HSCN)、异硫氰酸(HNCS)两种。两者沸点:前者_____后者(填“高于”或“低于”)。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为________________。

(5)铜与金形成的金属互化物的晶胞结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为__________g·cm-3。(用含a、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 688 | 810 | 860 |
①反应速率最大的时间段是(填0~1、1~2、2~3、3~4、4~5 )_____ min,原因是_____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为_________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列___________以减慢反应速率。(填写代号)
A.冰块 B.HNO3溶液 C.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质,A、B、C的物质的量随时间变化曲线如图。

①该反应的化学方程式是___________
②在该条件达到反应的限度(平衡状态)时反应物的转化率为____________
(转化率=(转化的物质的量/初始物质的量)×100%)(计算结果保留1位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com