
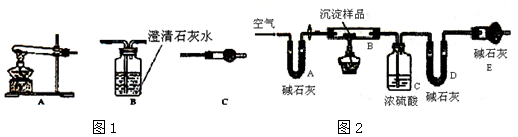
分析 Ⅰ.(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,澄清石灰水变浑浊说明含有CuCO3;
(2)甲同学的说法正确,C中不变蓝,而D中石灰水变浑浊;
Ⅱ.(1)实验开始时,首先检查装置的气密性,装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用空气除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除,实验结束氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,也应利用空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收;
(2)装置C质量增加了n克,说明分解生成ng水,根据水的质量计算沉淀中氢氧化铜的质量,沉淀质量减去氢氧化铜的质量等于碳酸铜的质量,再利用质量分数的定义计算;
Ⅲ.CaSO4和碳酸钠反应转化为CaCO3的离子方程式为:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),其平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$;
Ⅳ.蓝铜矿的主要成分为2CuCO3•Cu(OH)2,当它与焦炭一起加热时,可以生成铜、二氧化碳和水,Cu的化合价变化(+2→0),C的化合价变化(0→+4),根据得失电子守恒、原子守恒配平,有元素化合价变化的反应属于氧化还原反应.
解答 解:I.(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,即装置的连接顺序为A→C→B,
故答案为:A;C;B;
(2)甲同学的说法正确,则观察到C中无水硫酸铜不变蓝,而B中石灰水变浑浊,
故答案为:C中无水硫酸铜不变色,装置B中澄清石灰水变浑浊;
II.(1)实验开始时首先检查装置的气密性,实验结束时,氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,应用空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收,故答案为:检查装置的气密性;用空气将装置中的水蒸气和二氧化碳赶出;
(2)装置C质量增加了n克,说明分解生成ng水,水的物质的量为$\frac{n}{18}$mol,根据氢元素守恒可知氢氧化铜的物质的量为$\frac{n}{18}$mol,故氢氧化铜的质量为$\frac{n}{18}$mol×98g/mol=$\frac{49n}{9}$g,沉淀中CuCO3的质量分数为$\frac{mg-\frac{49n}{9}g}{mg}$×100%=(1-$\frac{49n}{9m}$)×100%,
故答案为:(1-$\frac{49n}{9m}$)×100%.
Ⅲ.平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{9.1×1{0}^{-6}}{2.8×1{0}^{-9}}$=3.25×103,
故答案为:3.25×103;
IV.蓝铜矿的主要成分为2CuCO3•Cu(OH)2,当它与焦炭一起加热时,可以生成铜、二氧化碳和水,该反应中Cu的化合价变化(+2→0),C的化合价变化(0→+4),1mol2CuCO3•Cu(OH)2反应生成3molCu,得到6mol电子,所以最小公倍数为12,所以C前系数为4,2CuCO3•Cu(OH)2前系数为2,根据原子守恒可得,该反应的化学方程式为:2[2CuCO3•Cu(OH)2]+3C$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+7CO2↑+2H2O,
故答案为:2[2CuCO3•Cu(OH)2]+3C=7CO2+6Cu+2H2O.
点评 本题考查对实验方案设计与装置的理解、实验基本操作、化学计算等,题目难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④⑥ | C. | ①④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在已知碱金属元素中具有最大的原子半径 | |
| B. | 其氧化物对应的水化物是极强的碱 | |
| C. | 在空气中燃烧时生成氧化物Fr2O | |
| D. | 在已知碱金属元素单质中熔点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
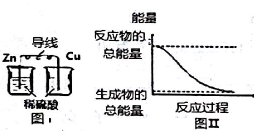
| A. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| B. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图Ⅱ所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
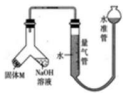 某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com