
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
【答案】3X(g)+Y(g)2Z(g) 1.8×103mol/(L·s) 946
【解析】
(1)由图中所给数据看,反应开始前,X、Y的物质的量都为1.0mol,而Z的物质的量为0,所以X、Y为反应物,Z为生成物;当各物质的量不变时,其物质的量都大于0,表明反应为可逆反应;再由物质的量的变化量之比等于化学计量数之比,可确定反应的化学计量数关系,从而写出反应方程式。
(2)从表中数据可得出,反应生成n(NH3)= 0.36mol,则参加反应的n(N2)= 0.18mol,从而求出0~50s内的平均反应速率v(N2)。
(3)利用H=E(N≡N)+3E(H-H)-6E(N-H),可求出E(N≡N)。
(1)由图中所给数据可得出,X、Y、Z的变化量分别为0.3mol、0.1mol、0.2mol,从而得出三者的物质的量之比为3:1:2,结合上面分析,可得出该反应的化学方程式为3X(g)+Y(g)2Z(g)。答案为:3X(g)+Y(g)2Z(g);
(2)从表中数据可得出,反应生成n(NH3)= 0.36mol,则参加反应的n(N2)=0.18mol,从而得出0~50s内的平均反应速率v(N2)=![]() = 1.8×103mol/(L·s)。答案为:1.8×103mol/(L·s);
= 1.8×103mol/(L·s)。答案为:1.8×103mol/(L·s);
(3)利用H=E(N≡N)+3E(H-H)-6E(N-H),可求出E(N≡N)=H-3E(H-H)+6E(N-H)=- 46×2kJ/mol-3×436kJ/mol+6×391kJ/mol=946 kJ/mol。答案为:946。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示![]() 已知A、B、C均为气体
已知A、B、C均为气体![]() 。
。

(1)该反应的化学方程式为_______________。
(2)反应开始至2分钟时,B的平均反应速率为_______________。
(3)能说明该反应已达到平衡状态的是_______________。
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______________。
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360s | 480s | 540s | 720s |
MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
①该研究小组在设计方案时。考虑了浓度、_______________、_______________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________。
(6)将质量相同但聚集状态不同的![]() 分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
催化剂 | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出![]() 发生分解的化学反应方程式_______________。
发生分解的化学反应方程式_______________。
②实验结果说明催化剂作用的大小与_______________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)
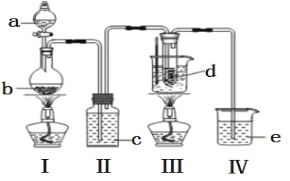
a 为浓盐酸,b 为MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为_____________________________________。
②若取消装置 II,对本实验的影响是___________________。
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________(填化学式)。
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2 溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3 标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是_________________。
②样品中 KClO3 的貭量分数为_____。(保留三位有效数字,KClO3 式量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是
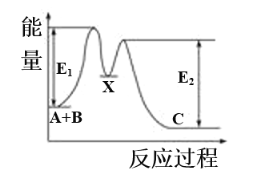
A. X是反应A+B→C的催化剂
B. 反应A+B→C的ΔH<0
C. E2表示反应X→C的活化能
D. 加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释是
A. 钢铁在潮湿的空气中比在干燥的空气中容易生锈
B. 实验室常用排饱和食盐水法收集氯气
C. 红棕色的 NO2,加压后气体颜色先变深后变浅
D. 工业利用反应:Na(l)+KCl(l)![]() NaCl(l)+ K(g)制取金属钾
NaCl(l)+ K(g)制取金属钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
① | ② | ③ | II中实验现象 |
| |
A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为浅红色 | |
B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
D | NH4Cl溶液 | NaAlO2溶液 | 紫色石蕊试液 | 溶液由紫色变为蓝色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是第三周期元素,它们最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol/L的溶液,其pH(25℃)与对应元素原子半径的关系如图所示。下列说法正确的是( )

A. 简单离子的半径:X>Z>W
B. 简单气态氢化物的稳定性:Z>W>Y
C. Y单质可用于制作半导体材料
D. n =2-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3) 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验,以确认某混合气体中含有 CH2=CH2 和SO2。
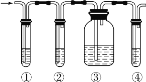
实验中提供的试剂有:A.品红溶液B.NaOH 溶液C.浓硫酸D.酸性 KMnO4 溶液试回答下列问题:
(1)写出图中①②③④ 装置盛放试剂的顺序为( 将上述有关试剂的序号填入空格内) ___________→___________→___________→___________。
(2)能说明混合气体中存在SO2 的现象是___________。
(3)能确定混合气体中存在乙烯的现象是___________。
(4)乙烯与溴水反应的化学方程式为_______,该反应的反应类型为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com