
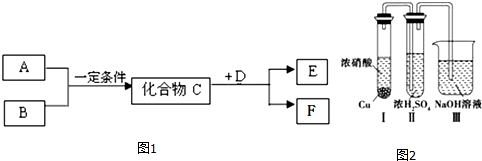
分析 (1)若C是一种淡黄色离子化合物判定为Na2O2,B、E为同种气体为氧气,则A为Na,过氧化钠和D反应得到F是一种水溶液显碱性的正盐,判断F为Na2CO3,D为CO2;
(2)若A、B反应生成C是人工工业固氮的反应原理,判断为是氨气和氢气合成氨的反应,生成化合物C为NH3,D是双原子分子气态单质,其密度为3.17g/L(标准标况下),则D的摩尔质量=3.17g/L×22.4L/mol=71g/mol,得到D为Cl2,F在常温下是一种无色晶体,且受热易分解,结合转化关系判断为NH4Cl;
(3)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸,推断C为NO2,D为H2O,F为HNO3,E为NO,
①C与D反应是二氧化氮和水反应生成硝酸和一氧化氮;
②小铜块和浓硝酸刚开始反应的一段时间内浓H2SO4中未发现有气体逸出,且浓硫酸颜色加深,说明生成的二氧化氮溶解于浓硫酸;
③装置Ⅲ是尾气处理防止氮氧化物污染空气;
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,是二氧化氮和氢氧化钠溶液反应生成亚硝酸钠、硝酸钠和水.
解答 解:(1)若C是一种淡黄色离子化合物判定为Na2O2,B、E为同种气体为氧气,则A为Na,过氧化钠和D反应得到F是一种水溶液显碱性的正盐,判断F为Na2CO3,D为CO2,C与D反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)若A、B反应生成C是人工工业固氮的反应原理,判断为是氨气和氢气合成氨的反应,生成化合物C为NH3,D是双原子分子气态单质,其密度为3.17g/L(标准标况下),则D的摩尔质量=3.17g/L×22.4L/mol=71g/mol,得到D为Cl2,F在常温下是一种无色晶体,且受热易分解,结合转化关系判断为NH4Cl,实验室检验无机盐F中阳离子是检验铵根离子的存在,设计实验为:取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子,
故答案为:取待测样品少许置于试管中,加氢氧化钠溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则待测样品含铵根离子;
(3)若C是一种气体,D在常温下是一种无色无味的液体,E为无色气体,F是一种强酸,推断C为NO2,D为H2O,F为HNO3,E为NO,
①C与D反应是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,可以得出NO2能溶于浓硫酸中,
故答案为:NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2;
③甲同学设计的实验中,装置Ⅲ的主要作用是:吸收尾气(NO2),防止污染空气,
故答案为:吸收尾气(NO2),防止污染空气;
④甲同学在实验过程中装置Ⅲ内发生一氧化还原反应生成两种钠盐,其中一种是外观与食盐很相似的有毒物质亚硝酸盐,是二氧化氮和氢氧化钠溶液反应生成亚硝酸钠、硝酸钠和水,反应的化学方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O,
故答案为:2NO2+2NaOH=NaNO2+NaNO3+H2O.
点评 本题考查无机物的推断,属于开放性题目,需要学生熟练掌握元素化合物知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物属于饱和链烃 | |
| B. | 该有机物可由两种单炔烃分别与氢气加成得到 | |
| C. | 该烃与2,3-二甲基丁烷互为同系物 | |
| D. | 该烃的一氯取代产物共有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA | |
| B. | 足量铜与含硝酸4 mol 的浓硝酸反应,生成氮的氧化物中氮的化合价为+4 价 | |
| C. | 1 mol 铜与足量浓硝酸反应,生成标况下气体体积为44.8 L | |
| D. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
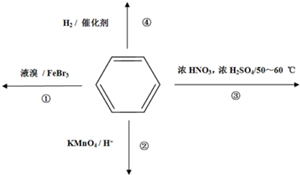
| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰为淡蓝色 | |
| C. | 反应③为取代反应,有机产物是一种烃的衍生物 | |
| D. | 反应④中1 mol苯最多与6 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间生成n mol A2同时生成n mol AB | |
| B. | 容器内总压不随时间变化 | |
| C. | 单位时间生成2n mol AB同时生成n mol B2 | |
| D. | 混合气体的平均相对分子质量不随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com