
| A. | Y元素为Na元素 | B. | X只能位于第3周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第2周期 |
分析 X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,X可能为二、三周期元素,Y可能为一、二周期元素,如X为第二周期元素,则Y只能为第一周期元素,则Y只能为H,X可能为N、O、F等,如Y为第二周期元素,可为Li、Be等元素,则X可能为S、Cl等元素,以此解答该题.
解答 解:X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,X可能为二、三周期元素,Y可能为一、二周期元素,如X为第二周期元素,则Y只能为第一周期元素,则Y只能为H,X可能为N、O、F等,如Y为第二周期元素,可为Li、Be等元素,则X可能为S、Cl等元素,
A.Y可能是H、Li或Be元素等,不可能为金属元素Na,故A错误;
B.X可能为二、三周期元素,如Y为第一周期元素,则X可为第二周期元素,Y为第二周期元素,则X为第三周期元素,故B错误;
C.aXn-比bYm+多两个电子层,如Y为第一周期元素,则X为第二周期元素,a+n-b+m=10,如Y为第二周期元素,则X为第三周期元素,a+n-b+m=18-2=16,故C正确;
D.由以上分析可知,Y可为Li、Be等第二周期元素,故D错误.
故选:C.
点评 本题考查原子结构与元素的性质,侧重于学生的分析能力的考查,注意把握原子结构与元素在周期表中的位置的关系,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 21 | C. | 20 | D. | 19 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.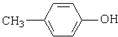 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com