
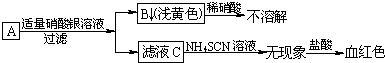
分析 A的水溶液中加AgNO3溶液产生淡黄色沉淀,不溶于硝酸,说明B是AgBr,A的水溶液含有Br-;滤液C先加NH4SCN溶液无现象,再加氯水溶液显红色,说明C溶液中存在Fe2+,即A的溶液含有Fe2+,故A为FeBr2,C为Fe(NO3)2.
解答 解:A的水溶液中加AgNO3溶液产生淡黄色沉淀,不溶于硝酸,说明B是AgBr,A的水溶液含有Br-;滤液C先加NH4SCN溶液无现象,再加氯水溶液显红色,说明C溶液中存在Fe2+,即A的溶液含有Fe2+,故A为FeBr2,C为Fe(NO3)2,
解:(1)由上述分析可知,A为FeBr2,B为AgBr;
故答案为:FeBr2,AgBr;
(2)Fe(NO3)2溶液中先加NH4SCN溶液无现象,再加稀盐酸溶液显红色,发生反应为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O、Fe3++3SCN-=Fe(SCN)3;
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O、Fe3++3SCN-=Fe(SCN)3.
点评 主要以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语、离子检验等,难度不大,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,根据转化关系与B的颜色推断出B是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 正向移动 | B. | 逆向移动 | ||
| C. | 不移动 | D. | 无法确定移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入酸性KMnO4溶液中,溶液的紫色褪去 | |
| B. | 乙烯与乙醇在浓硫酸作用下共热反应生成乙酸乙酯 | |
| C. | 苯与溴水混合振荡,溴水层的颜色变浅 | |
| D. | 苯与氢气在一定条件下反应生成环已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质置换金属单质 | B. | 金属单质置换非金属单质 | ||
| C. | 非金属单质置换金属单质 | D. | 非金属单质置换非金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉是混合物,漂粉精是纯净物 | |
| B. | 工业上将氯气通入澄清石灰水制取漂白粉 | |
| C. | 漂白粉的有效成分是Ca(ClO)2 | |
| D. | 漂白液的有效成份是Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:
已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图
原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图| A. | 将电能转化为化学能的装置 | B. | 电子由铜片经导线流向锌片 | ||
| C. | 锌片为负极,发生氧化反应 | D. | 铜片上发生的反应为Cu2++2e-═Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com