
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑥ | D. | ②④⑤ |
分析 要证明Fe3+具有氧化性,必须所加微粒和Fe3+发生氧化还原反应,而且加入的微粒作为还原剂,来解题.
解答 解:在①SCN-、②Fe、③Fe2+、④I- ⑤H2S、⑥OH-六种微粒中只有②④⑤能发生氧化还原反应,发生反应分别为:Fe+2Fe3+=3Fe2+、2I-+2Fe3+=2Fe2++I2、H2S+2Fe3+=2Fe2++S↓+2H+,而且这三个反应中Fe、I-、H2S都作还原剂,说明Fe3+具有氧化性,OH-与Fe3+反应属于非氧化还原反应.
故选D.
点评 本题考查了氧化还原反应,熟练掌握铁元素及化合物的化学性质和氧化还原反应中化合价的变化是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质名称 | 氯气 | 小苏打 | 二氧化硅 | 氧化铁 |
| 用途 | 制漂白粉 | 治疗胃酸过多 | 制半导体材料 | 用作红色涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
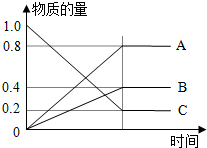 H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
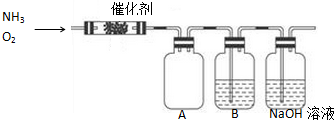
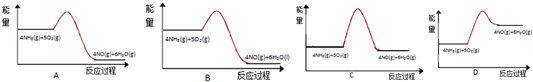
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯气和溴化钠溶液反应:C12+2Br-→2C1-+Br2 | |
| C. | 氢氧化钡和稀硫酸反应:SO42-+Ba2+→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
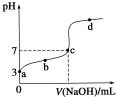 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3mol/L | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | 滴定过程中溶液中的n (CH3COO-)+n(CH3COOH)的和不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | NaOH溶液 | C. | 硫酸 | D. | KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
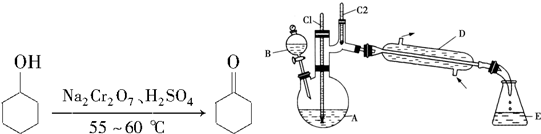
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.962 4 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.947 8 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 1 | |
| 水 | 100.0 | 0.998 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com