
����Ŀ��[��ѧ ѡ��2����ѧ�뼼��]
�������Ҫ�Ļ���ԭ�ϣ���N2��H2Ϊԭ����ȡ����淋�����ͼ���£���ش��������⣺

��1������������ͼ�У�B�豸�������� �����з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2����������ҵ�����У�N2��H2�ϳ�NH3�Ĵ����� ��1909�껯ѧ�ҹ�����ʵ�����״κϳ��˰���2007�껯ѧ�Ҹ���¡����ض��ڹ����о���֤ʵ�������뵪���ڹ����������ϳɰ��ķ�Ӧ���̣�ʾ��ͼ���£�

![]() �ֱ��ʾN2��H2��NH3 ��ͼ����ʾ���ɵ�NH3�뿪�������棬ͼ����ͼ���ĺ���ֱ��� �� ��
�ֱ��ʾN2��H2��NH3 ��ͼ����ʾ���ɵ�NH3�뿪�������棬ͼ����ͼ���ĺ���ֱ��� �� ��

��3��NH3��CO2��һ�������¿ɺϳ����أ��䷴ӦΪ��2NH3(g)+CO2(g) ![]() CO( NH2)2(s)+H2O(g)
CO( NH2)2(s)+H2O(g)
��ͼ��ʾ�ϳ����а�̼��a��CO2ת���ʦصĹ�ϵ��aΪ[n(NH3)/n(CO2)]��bΪˮ̼��[n(H2O)/n(CO2)]����
��bӦ������ �� A��1.5��1.6 B��1��1.1 C��0.6��0.7
��aӦ������4.0�������� ��
��4���ںϳɰ����豸���ϳ������У������Ƚ�������Ŀ���� ���ںϳ��������������ͨ�������Ŀ���� ��
��5����������Ĺ����г������һЩ��������������������ַ���������
��Һ���շ���NO+NO2+2NaOH��2NaNO2+H2O
NH3��ԭ����8NH3+6NO2![]() 7N2+12H2O��NOҲ�����Ƶķ�Ӧ��
7N2+12H2O��NOҲ�����Ƶķ�Ӧ��
�������ַ����У�������ɫ��ѧ���� ��
��6��ij���ʳ���NH3�Ʊ�NH4NO3����֪����NH3��NO�IJ�����96%��NO��HNO3�IJ�����92%������HNO3����ȥ��NH3������ռ�ܺ�NH3������������������ģ��� %��
���𰸡���1������¯ ![]()
��2����ɰ���������� N2��H2�������ڴ������棻 �ڴ������棬N2��H2�л�ѧ������
��3����C ��a����4.0��CO2ת����Ѹ����ߵ����ֵ����a��4.0֮������c(NH3)ת��������������
��4���������ȣ���Լ��Դ����ʹNOѭ�����ã�ȫ��ת����HNO3
��5��NH3��ԭ��
��6��53
��������
�����������1����������ҵ������������У�B�豸�ǽ��а��Ĵ�������Ӧ��������¯�н��У�������Ӧ�ķ���ʽΪ��4NH3+5O2![]() 4NO+6H2O����2����������ҵ�����У�N2��H2�ϳ�NH3�Ĵ�������ɰ�������������������ڴ�������ϳɰ���Ӧ���̵�˳��Ϊ��ͼ���������Ӻ�����������������濿����ͼ�����������������ڴ����ı��棬ͼ���ڴ����������·ֽ����ԭ�Ӻ͵�ԭ�ӣ�ͼ����ʾ��ԭ������ԭ�����½�ϳɰ����ӣ�ͼ�����ɵİ����뿪�������棬�ʴ�Ϊ����ɰ����N2��H2�������ڴ������棻�ڴ������棬N2��H2�л�ѧ�����ѣ���3������ͼ��֪��ˮ̼��[n��H2O����n��CO2��]b��ֵԽС����CO2ת���ʦ�Խ��bӦ������0.6��0.7����ѡC����a������4.0ʱ��CO2ת���ʦ��Ѿ��ﵽ�ϸߵ�ֵ����������߰�̼��[n��NH3����n��CO2��]��CO2ת���ʦ���������ߣ��ʿ�����4.0���ʴ�Ϊ��a����4.0��CO2ת����Ѹ����ߵ����ֵ����a��4.0֮������CO2ת��������������
4NO+6H2O����2����������ҵ�����У�N2��H2�ϳ�NH3�Ĵ�������ɰ�������������������ڴ�������ϳɰ���Ӧ���̵�˳��Ϊ��ͼ���������Ӻ�����������������濿����ͼ�����������������ڴ����ı��棬ͼ���ڴ����������·ֽ����ԭ�Ӻ͵�ԭ�ӣ�ͼ����ʾ��ԭ������ԭ�����½�ϳɰ����ӣ�ͼ�����ɵİ����뿪�������棬�ʴ�Ϊ����ɰ����N2��H2�������ڴ������棻�ڴ������棬N2��H2�л�ѧ�����ѣ���3������ͼ��֪��ˮ̼��[n��H2O����n��CO2��]b��ֵԽС����CO2ת���ʦ�Խ��bӦ������0.6��0.7����ѡC����a������4.0ʱ��CO2ת���ʦ��Ѿ��ﵽ�ϸߵ�ֵ����������߰�̼��[n��NH3����n��CO2��]��CO2ת���ʦ���������ߣ��ʿ�����4.0���ʴ�Ϊ��a����4.0��CO2ת����Ѹ����ߵ����ֵ����a��4.0֮������CO2ת��������������
��4���ϳɰ��ķ�Ӧ���ڷ��ȷ�Ӧ����Ӧ�����л�ų��������ȣ����Ƚ��������Գ���������ȣ���Լ��Դ�����������ж���������ˮ��Ӧ���������NO��ͨ�������NO�ܱ������е���������Ϊ����������������������ˮ��Ӧ�������ᣬ����ʹNOѭ�����ã�ȫ��ת��Ϊ����ʴ�Ϊ���������ȣ���Լ��Դ����ʹNOѭ�����ã�ȫ��ת����HNO3����5����Һ���շ���NO+NO2+2NaOH�T2NaNO2+H2O��NH3��ԭ����8NH3+6NO2![]() 7N2+12H2O��������֪��Һ���շ����Ĵ����������������ɵ��������ζ���NH3��ԭ����������Ⱦ���õ��ϳɰ���ԭ�������ʷ�����ɫ��ѧ���ǰ�����ԭ�����ʴ�Ϊ��NH3��ԭ������6�����ݵ�ԭ���غ��֪��NH3��NO��HNO3����1mol�����ɵõ���������ʵ���Ϊ��1mol��96%��92%=0.8832mol������HNO3+NH3�TNH4NO3��֪��Ӧ���ĵİ��������ʵ���Ϊ��0.8832mol��
7N2+12H2O��������֪��Һ���շ����Ĵ����������������ɵ��������ζ���NH3��ԭ����������Ⱦ���õ��ϳɰ���ԭ�������ʷ�����ɫ��ѧ���ǰ�����ԭ�����ʴ�Ϊ��NH3��ԭ������6�����ݵ�ԭ���غ��֪��NH3��NO��HNO3����1mol�����ɵõ���������ʵ���Ϊ��1mol��96%��92%=0.8832mol������HNO3+NH3�TNH4NO3��֪��Ӧ���ĵİ��������ʵ���Ϊ��0.8832mol��
����������֮�ȵ������ʵ���֮�ȣ�����HNO3����ȥ��NH3������ռ�ܺ�NH3�����İٷ���Ϊ��
1mol�£�1mol+0,8832mol����100%��53%.


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪�Ȼ�ѧ����ʽ��Zn(s)��1/2O2(g) ��ZnO(s) ��H1��Hg(l)��1/2O2(g) ��HgO(s) ��H2��
��Zn(s)��HgO(s)��Hg(l)��ZnO(s)����HֵΪ �����á�H1�͡�H2�Ĵ���ʽ��ʾ��
��2����Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����á���ӦA��4HCl(g)��O2(g) 2Cl2(g)��2H2O(g)������Ӧ��4mol HCl���������ų�115.6kJ���������Ҳ��ֻ�ѧ������ʾ��ͼ���£�
2Cl2(g)��2H2O(g)������Ӧ��4mol HCl���������ų�115.6kJ���������Ҳ��ֻ�ѧ������ʾ��ͼ���£�
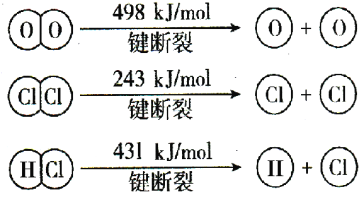
�ٷ�ӦA���Ȼ�ѧ����ʽ�� ��
�ڶϿ�1 mol H��O������Ҫ���յ�����Ϊ kJ��H2O��H��O ����HCl��H��Cl����ȣ� �ļ��ܽϴ�������H��O������H��Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��������ۺ���������Ӧ���������졣����˵����ȷ����
A����������������������������
B���������е����뾶��r(Al3+)��r(O2-)
C���ڸ÷�Ӧ�У����Ļ�ԭ��ǿ�����Ļ�ԭ��
D��1mol�������μӷ�Ӧת�Ƶ�����ԼΪ4��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϸ������ͼװ�ã�����������գ�

��1���÷�Ӧ�ĵ���������_____________��
��2�������е���������________��Һ���ƶ���
��3��һ��ʱ���пƬ�ϵ�������_____________��ͭƬ�ϵ�������______________��
��4��п������_________��Ӧ���ܷ�Ӧ����ʽΪ_________________��
��5��30min��1.3g��Zn�μ��˷�Ӧ����ת����_______�����ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
���̿���Ҫ�ɷ�ΪMnO2���������Ʊ��̼��仯���
��1������ұ�������̵�һ�ַ��������������̿�����Mn3O4�����������ȷ�Ӧԭ���Ƶ��̣������ȷ�Ӧ�Ļ�ѧ����ʽΪ_______________��
��2���ִ�ұ�������̵�һ�ֹ�����������ͼ��ʾ��
�±�Ϊt��ʱ���й����ʵ�pKsp��ע��pKsp =��lgKsp����
���� | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
���̿�ԭ�����ķ�ӦΪ��12MnO2��C6H12O6��12H2SO4 ![]() 12MnSO4��6CO2����18H2O
12MnSO4��6CO2����18H2O
���÷�Ӧ�У���ԭ��Ϊ_______��д��һ�������ԭ�������ʵĴ�ʩ��_______��
����Һ1��pH_______����������������С����������������MnSO4����Һ��pH��
�ۼ���MnF2����ҪĿ���dz�ȥ ����Ca2+��Fe3+��Cu2+����
��3����MnSO4��ȡMnCO3����MnSO4��Һ�м������NH4HCO3��Һ���÷�Ӧ�����ӷ���ʽΪ____________������MnSO4��Һ�м���(NH4)2CO3��Һ���������Mn(OH)2�����ܵ�ԭ������MnCO3(s)��2OH��(aq)![]() Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ�D�Dѡ��2����ѧ�뼼��]�������Ҷ�����������ԭ���ͳ����������ڽ������⡢֯��Ư��ϡ��������һ���Ʊ��������������ᾧˮ���Ĺ����������£�

�ش��������⣺
��1��CO��NaOH��һ�������ºϳɼ����ơ������Ƽ�������Ļ�ѧ��Ӧ����ʽ�ֱ�Ϊ �� ��
��2�����Ʊ������������ι��˲���,���˲����ٵ���Һ�� �������� _____�����˲����ڵ���Һ�� __�� ��������________ ��
��3�����չ����Тۺܵ͢�Ŀ���� ��
��4�����˽�������������ֱ���������ữ�Ʊ����ᡣ�÷�����ȱ���Dz�Ʒ���������к��е�������Ҫ�� ��
��5���ᾧˮ�ϲ����Ʒ�Ĵ����ø�����ط��ⶨ�����������Ʒ0.250g����ˮ����0.0500mol/L������KMnO4��Һ�ζ�����dz�ۺ�ɫ�����ʣ�����KMnO4��Һ15.00mL����Ӧ�����ӷ���ʽΪ ����ʽ����ó�Ʒ�Ĵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ͭ��������Ļ���������Cu4O(PO4)2����ͨ�����з�Ӧ�Ʊ���2Na3PO4��4CuSO4��2NH3��H2O===Cu4O(PO4)2����3Na2SO4��(NH4)2SO4��H2O
��1����NH3��Ϊ�ȵ�����ķ��ӡ�������________��________(����һ��)��
��2��������ͭ��Һ�м������KCN�����������[Cu(CN)4]2������1 mol CN���к��е���������ĿΪ________������������[Cu(H2O)4]2+�ṹ���ƣ�������ӵĿռ乹��Ϊ ��
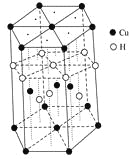
��3��CuԪ����HԪ�ؿ��γ�һ�ֺ�ɫ������侧��ṹ��Ԫ��ͼ��ʾ����û�����Ļ�ѧʽΪ________��
��4�� ��ȩ(H2C=O)��Ni�������¼���ɵü״�(CH3OH)���״������ڵ�O��C��H����________(������������������������С����)��ȩ�����ڵ�O��C��H���ǣ��״�������ˮ��ԭ���� ��
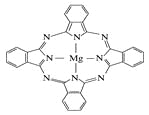
��5�� ����̪ݼ������ڹ�̫���ܵ��������Ҫ���ã�һ�ֽ���þ̪ݼ�����Ľṹ��ͼ��ʾ������Nԭ�ӵ��ӻ���ʽΪ ������ͼ�ķ���������ͼ���ü�ͷ��ʾ����λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ѱ�ҶԻ����������ÿ��ٵ������������ж�������(ClO2)��Ŀǰ�����ϱ�����Ŀ�ĵ��Ĵ���Ч����������������ҵ���ó�ʪ��KClO3�Ͳ���(H2C2O4)��60��ʱ��Ӧ�Ƶá�ij��ȤС���ѧ�����������ģ��װ������ȡ���ռ�ClO2���ⶨ��������
�������ϣ�ClO2��һ�ֻƺ�ɫ�д̼�����ζ�����壬���۵�Ϊ��59�����е�Ϊ11.0�����¶ȹ��߿�������ը��������ˮ�������Һ��Ӧ��


ʵ��������ȡ���ռ�ClO2����ͼ1װ����ʾ��
��1��װ��A�з�Ӧ������K2CO3��ClO2��CO2�ȣ���д���÷�Ӧ�Ļ�ѧ����ʽ__________��
��2��װ��A���������¶ȿ���װ�ã����¶�Ҫ������60��80��֮�䣬�����¶ȵ�Ŀ����__________��װ��BҲ���������¶ȿ���װ�ã�Ӧ����__________��������ˮԡ��������ˮԡ������60������ˮԡ����װ�á�
ʵ�������ⶨClO2��������ͼ2װ����ʾ���������£�
����ƿ�м��������ĵ⻯�أ���100mLˮ�ܽ���ټ�3mL������Һ������ͼ2��װ���������ڲ���Һ����м���ˮ����û���ܿڣ������ɵ�ClO2�����ɵ���ͨ����ƿ����Һ�г�����պѲ���Һ����е�ˮ��Һ������ƿ�У�������ƿ�м��뼸�ε�����Һ����cmol/L��������Ʊ�Һ�ζ���ƿ�е�Һ�壬����ȥVmL�����������Һ����֪��I2��2S2O32��=2I����S4O62������
��3��װ���в���Һ��ܵ�������____________________��
��4���ζ��յ��������____________________��
��5�����ͨ��ClO2������m(ClO2)=__________g�����������ĺ�c��V�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ĵ�������к���ͭ�����Ƚ��������Ϊʵ����Դ�Ļ������ò���Ч��ֹ������Ⱦ,������¹�������:

������ | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
��ʼ������pH | 2.3 | 7.6 | 4.4 |
��ȫ������pH | 3.2 | 9.7 | 6.4 |
��1����������H2O2��Ŀ���� ����pH�����м�����Լ������ (�ѧʽ)��ʵ���ҽ��й��˲������õ��IJ��������� �� �� ��
��2�����CuSO4��Һ��ԭ���� ����CuSO4��Һ�м���һ������NaCl��Na2SO3,�������ɰ�ɫ��CuCl����,д���÷�Ӧ�Ļ�ѧ����ʽ ��
��3��Fe3+����ˮ�ⷴӦFe3++3H2O![]() Fe(OH)3+3H+,�÷�Ӧ��ƽ�ⳣ������ʽΪ ��
Fe(OH)3+3H+,�÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��4����ȡ���Ʊ���CuCl��Ʒ0.250 0 g����һ������0.5 mol��L-1FeCl3��Һ��,����Ʒ��ȫ�ܽ��,��ˮ20 mL,��0.100 0 mol��L-1��Ce(SO4)2��Һ�ζ�,�����յ�ʱ����Ce(SO4)2��Һ25.00 mL���йصĻ�ѧ��ӦΪFe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+�������CuCl��Ʒ���������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com