
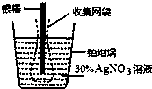
 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )| A. | 电量计工作时溶液里的阴离子向正极移动 | |
| B. | 电量计工作时银棒应与电源的正极相连 | |
| C. | 网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏低 | |
| D. | 若得金属银的沉积量为1.08g,则电解过程中转移的电子为0.01mol |
分析 A.阴离子向阳极移动;
B.银作阴极,与原电池负极相连;
C.电解时阳极的银容易脱落而影响实验结果;
D.根据银和转移电子之间的关系式计算.
解答 解:A.电解时,电解质溶液中阴离子向阳极移动,故A错误;
B.电解时,银上得电子发生还原反应,所以银作阴极,与电源负极相连,故B错误;
C.银溶解时有些可能未失电子变成银离子然后在阴极(铂坩埚)得电子析出,而是直接跌落到铂坩埚中,造成铂坩埚增重较多,导致计算出的电量偏大,故C错误;
D.银的物质的量=$\frac{1.08g}{108g/mol}$=0.01mol,转移电子的物质的量=0.01mol×(1-0)=0.01mol,故D正确;
故选D.
点评 本题考查了电解原理,根据电极上得失电子及物质间的反应来分析解答,易错选项是C,知道收集袋的作用,难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.2×10-3mol | B. | 3.2×10-3mol | C. | 4.4×10-3mol | D. | 4.8×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1 mol/L-1SO2的溶液中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO3-、SO42- | |
| C. | 碱性溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、MnO4-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•Lˉ1的醋酸溶液中CH3COOH和CH3COOˉ的总数为NA | |
| B. | 1 molNa2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 39g苯中所含的碳碳双键为1.5 NA | |
| D. | 23g乙醇中所含的羟基数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | 元素Z位于元素周期表的第3周期Ⅵ族 | |
| C. | Y形成的单质能在二氧化碳中燃烧 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中c(B-)为1.6×10-3mol/L | |
| B. | 溶液中c(B-)为1.7×10-13mol/L | |
| C. | AB2比AC更难溶解 | |
| D. | 因两者不同类而无法比较其溶解度的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
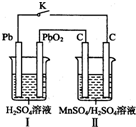 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com