
| A. | 溶液变红色 | B. | 溶液变蓝色 | ||
| C. | 溶液变紫色 | D. | 溶液颜色先变红后立即消失 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 中和反应生成盐和水,但生成盐和水的反应不一定是中和反应 | |
| B. | 分解反应就是一种物质生成两种或两种以上物质的反应 | |
| C. | 合金是金属材料,所以合金都是由金属元素组成的 | |
| D. | 酸溶液呈酸性,碱溶液呈碱性,盐溶液也不一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| B. | 含大量Fe3+的溶液中:K+、I-、SO42-、NO3- | |
| C. | 由水电离出的c(H+)=1.0×10-14 mol•L-1的溶液中:Mg2+、K+、Cl-、SO42- | |
| D. | 与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
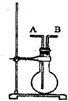 现有下列四种物质,①H2②Cl2③SO2④H2SO4请回答相关问题:
现有下列四种物质,①H2②Cl2③SO2④H2SO4请回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | NH4+、Fe3+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.49g | B. | 3.60g | C. | 3.81g | D. | 3.92g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
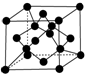 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com