
在恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生反应:A(g)+2B(g)  2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强之比为(a+b)∶(a+b-n/2)
C.若起始时放入2 a mol A和2b mol B,则达到平衡时生成2nmol C
D.当2V正(A)=2V逆(B) 时,可证明反应达到平衡状态
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.01mol·L-1Ba(OH)2溶液中:Al3+、NH4+、NO 、HCO
、HCO

B.0.1mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO-
C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、I-
D.由水电离产生的c(H+)=1×10-13mol·L-1的溶液中:Na+、Ba2+、NO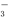 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
一定条件下存在反应:H2(g)+I2(g)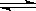 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C.容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
室温下,下列溶液中粒子浓度关系正确的是
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
不同温度下,水溶液中c(H+)与 c(OH+)的关系如图所示,下列说法正确的是
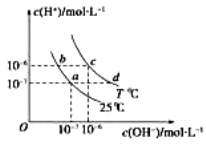
A.若从a点到c点,可采用在水中加入酸的方法
B.b点对应的醋酸中由水电离的c(H+)=10-6mol·L-1
C.T ℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11
D.c点对应溶液的Kw大于d点对应溶液的Kw
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
N2H4是一种高效清洁的火箭燃料。已知0.5molN2H4(g)完全燃烧生成氨气和气态水时,放出267kJ热量.则下列热化学方程中正确的是
A.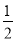 N2H4(g)+
N2H4(g)+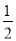 O2(g)=
O2(g)=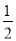 N2(g)+H2O(g) △H=+267kJ/mol
N2(g)+H2O(g) △H=+267kJ/mol
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ/mol
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJ/mol
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
用惰性电极电解一定浓度的额CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和PH(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:选择题
一定条件下,对反应C(s)+CO2(g) 2CO(g) ΔH>0分别进行下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著加快的是
2CO(g) ΔH>0分别进行下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著加快的是
A.①②③ B.①③④ C.①② D.①③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:实验题
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液。
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/LNaOH溶液滴定,消耗NaOH溶液20.00mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3)完成并配平下列离子方程式: C2O42-+ MnO4-+ H+= CO2↑+ Mn2++
(4)步骤③中判断滴定终点的方法是 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)试样中H2C2O4·2H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com