
【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
【答案】酸式 滴加最后一滴AgNO3溶液时,生成砖红色沉淀,且半分钟不变色 14.20 1.8×10-2 1.8×10-8 CD
【解析】
(1)用0.0010 mol·L-1AgNO3溶液滴定,AgNO3为强酸弱碱盐,水解使溶液呈酸性,必须盛放于酸式滴定管中;
(2)当Cl-恰好沉淀完全时,再滴加一滴硝酸银溶液,Ag+与CrO42-生成Ag2CrO4砖红色沉淀;
(3)依据表中数据,计算即可;
(4)依据溶度积常数Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12计算;
(5)根据实验过程中,不当操作所引起的c(Cl-)的变化讨论;
(1)用0.0010 mol·L-1AgNO3溶液做滴定液,AgNO3为强酸弱碱盐,水解使溶液呈酸性,必须盛放于酸式滴定管中;
本题答案为:酸式。
(2)当Cl-恰好沉淀完全时,再滴加一滴硝酸银溶液,Ag+与CrO42-生成Ag2CrO4砖红色沉淀,且30s内不变色;
本题答案为:滴加最后一滴AgNO3溶液时,生成砖红色沉淀,且半分钟不变色 。
(3)第1组硝酸银溶液体积的数据与第2组和第3组相比,误差较大,舍去第1组数据,用第2组和第3组数据的平均值计算。消耗的硝酸银溶液的体积的平均值为(3.99+4.01)×10-3L/2=4×10-3L,n(Cl-)=n(Ag+)=4×10-3L×0.001 mol/L=4×10-6mol,m(Cl-)=4×10-6×35.5×103mg=142×10-3mg,水样中氯离子的含量为142×10-3mg÷(10×10-3L)=14.20 mg/L;
本题答案为:14.20。
(4)①当溶液中的残余c(Cl-)=1.8×10-5mol/L时,根据c(Cl-)×c(Ag+)=1.8×10-10,则c(Ag+)=1×10-5mol/L,又依据Ksp(Ag2CrO4)= 1.8×10-12,即c(CrO42-)×c2(Ag+)= 1.8×10-12,解得c(CrO42-)=1.8×10-2mol/L;②对于2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,平衡常数K=c2(Cl-)/c(CrO42-)c2(Cl-)×c2(Ag+)/c(CrO42-)×c2(Ag+)=
2Cl-+Ag2CrO4,平衡常数K=c2(Cl-)/c(CrO42-)c2(Cl-)×c2(Ag+)/c(CrO42-)×c2(Ag+)=![]() = (1.8×10-10)2/(1.8×10-12)=1.8×10-8;
= (1.8×10-10)2/(1.8×10-12)=1.8×10-8;
本题答案为:1.8×10-2mol/L,1.8×10-8。
(5)锥形瓶洗涤后不需要干燥,对测定结果无影响;滴定前,未使用标准液润洗滴定管,标准液浓度变小,所消耗标准液体积偏大,结果偏大;酸式滴定管滴定前仰视读数,滴定后俯视读数,导致读数偏小,结果偏低;酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡,有部分液体未放出,所耗标准液体积偏小,结果偏低。所以造成实验测定结果偏低的是CD;
本题答案为:CD。


科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
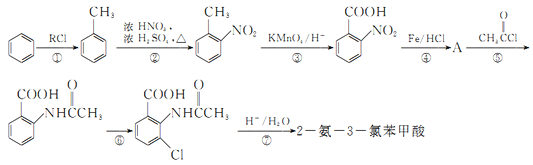
已知:
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
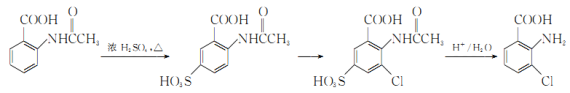
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实验操作不能达到实验目的或得出相应结论的是
选项 | 实验操作 | 实验目的或结论 |
A | 向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,完全反应后收集H2的体积 | 比较两种酸的电离程度 |
B | 将混有Ca(OH)2杂质的 Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。 | 除去Mg(OH)2样品中的Ca(OH)2杂质 |
C | 向盛有1mL0.01mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成,再滴加0.01mol/L NaI溶液,产生黄色沉淀。 | 常温下,Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 | HSO3-结合H+的能力比SO32-的弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=lgc(M),p(CO32)=lgc(CO32)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A. 线a表示ACO3的溶解平衡曲线
B. 该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C. 向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全)
D. ACO3的Ksp=10—4.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是用于治疗帕金森病的药物,名称为匹莫范色林,一种合成路线如图所示:
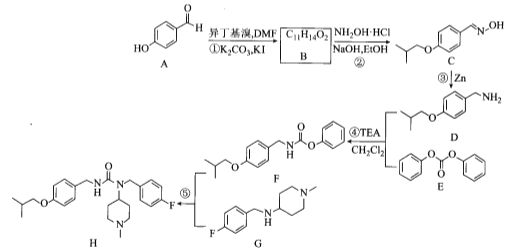
请回答下列问题:
(1)A的化学名称为_____________。
(2)B的结构简式为____________。
(3)D中官能团的名称是__________。
(4)③、⑤的反应类型分别为________、________。
(5)反应④的化学方程式为______________。
(6)芳香化合物X是E的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应也能发生银镜反应,其核磁共振氢谱显示有6种不同化学环境的氢,符合条件的X有:___种,写出其中一种的结构简式:________。
(7)已知: 。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备
。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,在直流电场的作用下,两膜中间的NH4+和NO2—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.工作一段时间后,在两极区均得到副产品NH4NO3.下列叙述正确的是

A. a极为电源负极,b极为电源正极
B. c膜是阴离子交换膜,d膜是阳离子交换膜
C. 阴极电极反应式为2NO3-+12H++10e-=N2 +6H2O
D. 当电路中通过1mol电子的电量时,会有5.6LO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:

(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: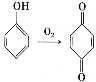 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(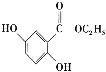 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com