

| 金属C |
| Cl2 |
| 金属C |
| Cl2 |


科目:高中化学 来源: 题型:
| A、依据元素的原子序数,推断该元素原子的核外电子数 |
| B、依据物质相对分子质量,推断物质熔、沸点的高低 |
| C、依据气体的摩尔质量,推断相同状态下不同气体密度的大小 |
| D、依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
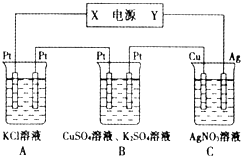 Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.
Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
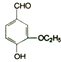 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3句 | B、4句 | C、5句 | D、6句 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com