
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸; ②用酒精洗涤粘有硫粉的试管;
③用托盘天平称量10.1 g氯化钠晶体; ④用饱和NaHCO3溶液除之CO2中的少量SO2;
⑤用瓷坩埚熔融NaOH固体; ⑥实验中不慎将手指划破,可立即用FeCl3溶液止血
A.①②③④ B.③④⑥
C.③④⑤ D.③⑤⑥
B
【解析】
试题分析:①在实验室量取液体时,因为量程太大,会使区分度增大,而加大误差;量程太小,需量取多次,也会加大误差,采用就近原则,所以不能用50mL量筒量取5.2mL稀硫酸,①错误;②.硫粉不溶于水,微溶于酒精,易溶于二硫化碳,所以用二硫化碳洗涤粘有硫粉的试管,②错误;③托盘天平精确到0.1g,故可用托盘天平称量11.7g氯化钠晶体,③正确;④因SO2与饱和碳酸氢钠溶液反应生成CO2,所以能用饱和NaHCO3溶液除之CO2中的少量SO2,④正确;⑤瓷坩埚中含有二氧化硅,与NaOH在加热下反应,而使坩埚炸裂,⑤错误;⑥血液属于胶体,FeCl3溶液能使胶体聚沉,堵塞血管,⑥正确;选B。
考点:考查化学实验常用仪器。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:选择题
下列溶液中,各组离子一定能大量共存的是( )
A.在强酸性溶液中:K+、NH4+、SO42-、ClO-
B.能使石蕊试液呈蓝色的溶液中:Na+、I-、Cl-、NO3-
C.在pH=1的溶液中:SO42-、Fe2+、Mg2+、NO3-
D.含有大量Al3+的溶液中:NH4+、Na+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
下列关于铝的叙述中正确的是
A.铝合金是一种混合物,它比纯铝的熔点高
B.由于铝的导电性比铜、银都强,所以常用其制造电线、电缆
C.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属
D.常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:填空题
溶液配制是中学化学实验的基本操作。
(1)用氢氧化钠固体配制100 mL 1.0mol·L-1氢氧化钠溶液时,需要用到的玻璃仪器有玻璃棒、胶头滴管、烧杯、量筒和 ________________________________。
(2)配制一定物质的量浓度溶液时用到的仪器较多,下列有关叙述正确的是_____。
a.称量NaOH固体时,分别在天平的两个托盘垫上相同大小的纸片
b.玻璃棒的作用是搅拌、引流
c.用浓硫酸配制稀溶液时,在量筒中稀释后要冷却至室温再转移到容量瓶中
d.容量瓶在使用前要检查是否漏水
(3)实验室配制一定物质的量浓度硫酸溶液,在用量筒量取浓硫酸时俯视读数,结果配制出的硫酸溶液浓度将会________。(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO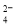 、S2-、SO
、S2-、SO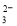
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(12分)甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下:
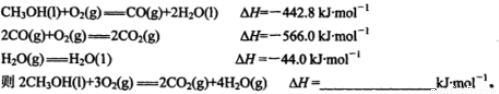
(2)工业上正在研究利用CO2和H2来生产甲醇燃料的方法,该反应为:
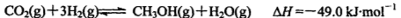
在某温度下,将6mol CO2和8mol H2 充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
①用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH) = .
②此温度下该反应平衡常数K=____________;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率_________75% (填“大于”、“小于”或“等于”)。
(3) 一氧化碳与氢气也可以合成甲醇: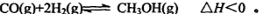
①若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的焓变不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数
K=50 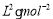 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:

请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
将Q和R加入到密闭体系中,在一定条件下发生反应3Q(s)+R(g)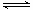 2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
| 1 MPa | 2 MPa | 3 MPa |
500℃ | 45.3% |
|
|
700℃ | a | 66.7% |
|
900℃ |
|
| 73.6% |
下列说法正确的是
A.该反应的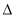 H<0
H<0
B.45.3%<a<66.7%
C.该反应的平衡常数K(900℃)>K(700℃)
D.700℃、2 MPa时R的转化率为50%
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
下列实验操作或装置(略去部分加持仪器)正确的是
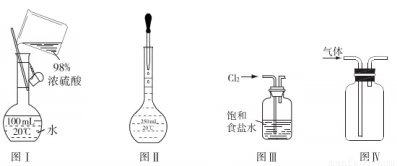
A.图Ⅰ表示为配制一定物质的量浓度稀硫酸时的操作
B.图Ⅱ表示为配制一定物质的量浓度的溶液定容时的操作
C.用图Ⅲ所示装置吸收氯气中的氯化氢气体
D.用图Ⅳ所示装置收集一氧化氮气体
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:填空题
(14分)某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母) 。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 | | | | | | |
序号 | a | b | c | d | e | f |
(3)下列情况会使所配溶液浓度偏低的是(填序号)
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
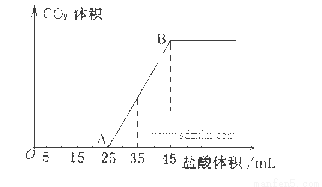
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为__________mL;
②计算所取氢氧化钠溶液的体积V=__________mL。
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为__________________________________,逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸________ mL才能使生成的沉淀完全溶解。
L-1的盐酸________ mL才能使生成的沉淀完全溶解。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com