
关于0.1 mol/L H2SO4溶液的叙述错误的是( )
A.1 L该溶液中含有H2SO4的质量为9.8 g
B.0.5 L该溶液中氢离子的物质的量浓度为0.2 mol/L
C.从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.01 mol/L
D.取该溶液10 mL,加水稀释至100 mL后H2SO4的物质的量浓度为0.01 mol/L
科目:高中化学 来源:2015-2016学年辽宁省高二下期初摸底化学卷(解析版) 题型:选择题
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g) 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
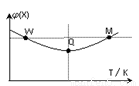
A.升高温度,平衡常数增大
B.W点X的正反应速率小于M点X的正反应速率
C.Q点时,Y的转化率最小
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学考试化学试卷(解析版) 题型:填空题
在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是_______;N2和H2的转化率比是_________。
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量__________,密度___________。(填“变大”、“变小”或“不变” )
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向__________移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向_______________移动。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将______________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____________(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学考试化学试卷(解析版) 题型:选择题
已知反应2CO(g)= 2C(s)+O2(g)的ΔH为正值,ΔS为负值。设ΔH和ΔS不随温度而变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行
D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高一上第一次双周练化学卷(解析版) 题型:实验题
某实验室需要配制480 mL 0.10 mol/L Na2CO3溶液。

(1)所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、 。
(2)实验时图中所示操作的先后顺序为 (填编号)
(3)在配制过程中,下列操作对所配溶液浓度有无影响?(填“偏高”、“偏低”或“无影响”)
①称量时误用“左码右物” 。
②转移溶液后没有洗涤烧杯和玻璃棒 。
③向容量瓶加水定容时俯视液面 。
④摇匀后液面下降,再加水至刻度线 。
⑤使用前容量瓶用蒸馏水洗涤,且没有干燥 。
⑥定容后经振荡、摇匀,静置液面下降 。
(4)所需Na2CO3固体的质量为 g;若改用浓溶液稀释,需要量取2 mol/L Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高一上第一次双周练化学卷(解析版) 题型:选择题
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤。正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高一上第一次双周练化学卷(解析版) 题型:选择题
现有下列仪器:烧杯、铁架台(带铁圈)、三角架、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是( )
A. 过滤 B. 蒸发 C. 分液 D. 萃取
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:选择题
已知N2+O2=2NO为吸热反应,ΔH=+180 kJ·molˉ1,其中N≡N、O=O键的键能分别为946 kJ·molˉ1、498 kJ·molˉ1,则N-O键的键能为( )
A.1264 kJ·mol﹣1 B.632 kJ·mol﹣1 C.316 kJ·mol﹣1 D.1624 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:填空题
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)△H<0
2SO3(g)△H<0
(1)如果2min内SO2的 浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示.根据图示回答下列问题:
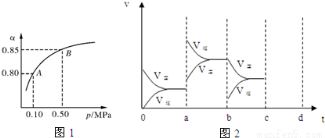
该反应的平衡常数的表达式为 平衡状态由A变到B时平衡常数K(A) K(B)(填“>”、“<”或“=”).
(2)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是 (填字母).
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化
(4)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~ b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,请把反应速率变化情况画在c~d处.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com