
(本题共12分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品中的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9;SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
请回答下列问题:
(一)绿矾的制备
38.检验制得的绿矾中是否含有Fe3+的实验操作是 。
39.操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
40.操作IV的顺序依次为: 、冷却结晶、 。
(二)绿矾中FeSO4·7H2O含量的测定
若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2+ + MnO4—+8H+?5Fe3+ +Mn2++4H2O 。
实验方案如下:
① 称取15.041 g绿矾产品,溶解,在250mL容量瓶中定容。
② 量取25.00mL待测溶液于锥形瓶中。
③ 用0.0500mol/L KMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
41.上述实验方案中的步骤④是 。洁净的滴定管在滴定前必须进行的操作有:
① 检验活塞是否漏水;
② ;
③ 向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
(三)数据处理
某小组同学的实验数据记录如下:
实验次数 | 初读数(mL) | 末读数(mL) |
1 | 0.20 | 21.40 |
2 | 0.00 | 21.00 |
3 | 1.60 | 26.60 |
42.上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留三位小数)。
38、取少量绿矾晶体加水溶解,滴加KSCN溶液,看溶液是否呈红色(1分×2)。
39、除去溶液中的Sn2+,并防止Fe2+被氧化(1x2分); 防止Fe2+生成沉淀(1分)
40、蒸发浓缩 过滤洗涤(1x2分) 41、重复操作②③1~2次或做平行实验1~2次(1分)。
② 用蒸馏水洗涤2~3次,再用高锰酸钾标准溶液润洗滴定管2~3次(1分)。 42、0.975(3分)
【解析】
试题分析:38、铁离子能与KSCN溶液反应使溶液显红色,因此检验制得的绿矾中是否含有Fe3+的实验操作是取少量绿矾晶体加水溶解,滴加KSCN溶液,看溶液是否呈红色。
39、由于溶液中含有Sn2+,需要除去。且亚铁离子易被氧化,而铁离子能氧化H2S生成亚铁离子,所以操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+,并防止Fe2+被氧化;由于溶液的酸性降低时容易析出氢氧化亚铁沉淀,所以在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀。
40、从溶液中得到绿矾晶体的实验操作是蒸发浓缩、冷却结晶,然后过滤洗涤干燥即可。
41、为了减少实验误差,需要重复实验,因此上述实验方案中的步骤④是重复操作②③1~2次或做平行实验1~2次。洁净的滴定管在滴定前必须进行的操作除了查漏以外,还必须用蒸馏水洗涤2~3次,再用高锰酸钾标准溶液润洗滴定管2~3次,最后调整液面。
42、根据表中数据可知三次实验消耗高锰酸钾溶液的体积是21.20ml、21.00ml、25.00ml,显然第三次实验数据误差太大,舍去,则消耗高锰酸钾溶液体积的平均值是21.10ml,因此根据方程式可知250ml溶液中亚铁离子的物质的量是0.0500mol/L×0.0211L×5×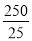 =0.05275mol,则绿矾的质量是0.05275mol×278g/mol=14.6645g,所以上述样品中FeSO4·7H2O的质量分数为14.6645g÷15.041 g=0.975。
=0.05275mol,则绿矾的质量是0.05275mol×278g/mol=14.6645g,所以上述样品中FeSO4·7H2O的质量分数为14.6645g÷15.041 g=0.975。
考点:考查绿矾晶体制备工艺流程图的分析与应用


科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A.若以CH4—空气燃料电池为直流电源,燃料电池的b极应通入空气
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极反应CH3CHO -2e- + 2H+== CH3COOH + H2O
D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:填空题
(本题共12分)氯酸镁[ Mg(ClO3)2 ]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

38.加速卤块在KMnO4溶液中溶解的措施有: (写出一点即可)。
39.加入MgO的作用是 ;过滤后所得滤渣的主要成分为 。
40.加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;② ;③ ;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
41.①写出步骤2中发生反应的离子方程式: ;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果 (填“偏大”、“偏小”或“不变”);
42.若平均消耗K2Cr2O7 溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
有五种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③NaAlO2 ④Na2CO3 ⑤NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是
A.①②③④⑤ B.②③④⑤ C.③④⑤ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
关于 16O和18O的说法正确的是
A.16O与18O互为同分异构体
B.16O与18O核外电子排布不同
C.通过化学变化可以实现16O与18O间的转化
D.标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
为了保护环境,工业上常用氨气除去废气中氮氧化物(NOx):NOx+NH3→N2+H2O(l)。已知某厂每升废气中含NOx 0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况)。有关说法中正确的是
A.每生成1.5mol N2,被氧化的气体有3mol
B.处理过程中转移的电子数约为1.339NA
C.NOx 中的 x 值为1.2
D.除去废气中的NOx,至少需氨0.24mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:填空题
昆石属于稀有的石种,其成分主要是二氧化硅以及铁、钠、钙元素的氧化物,根据图示流程回答有关问题。

39.操作1和操作4的名称分别是________和_________。
40.写出加CaO时发生反应的离子方程式:________。
41.在沉淀2后,依次进行了洗涤、干燥、灼烧操作,证明沉淀已经洗涤干净的操作是
________________________________________________________________________
42.证明滤液3含有钠元素的方法是________________________________________
43.写出能证明红棕色固体中含有金属元素的操作过程、现象、结论。
________________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,氨气和氟气可以发生反应:4NH3+3F2 → NF3+3NH4F,其中NF3分子空间构型与NH3相似。下列说法错误的是
A.NF3是由极性键构成的极性分子
B.氧化产物只有NF3,还原产物有NF3和NH4F
C.4 mol NH3被氧化时转移电子的物质的量为6 mol
D.NH4F属于离子晶体,既含有离子键又含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com