
【题目】下列说法正确的是()
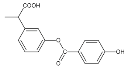
①分子式为C16H14O5 ②能使酸性高锰酸钾溶液褪色 ③能发生加成反应,但不能发生取代反应 ④苯环上的一溴代物有6种 ⑤1mol 该有机物与NaOH反应时最多消耗4mol NaOH ⑥1mol该有机物在一定条件下和H2反应,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )
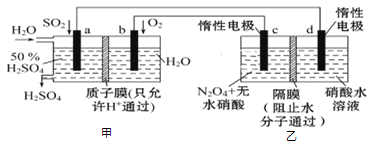
A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.澄清石灰水中加入过量小苏打溶液:![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O ===2C6H5OH↓+![]()
C.潮湿环境中钢铁发生电化学腐蚀的反应:Fe+2H2O=Fe(OH)2+H2↑
D.酸性溶液中KIO3与KI反应生成I2:![]() +5I-+6H+=3I2+3H2O
+5I-+6H+=3I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积均为1 L的密闭容器中分别充入a mol H2、0.5 mol CO2和1 mol H2、0.5 mol CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率与温度的关系如图所示。下列说法正确的是
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率与温度的关系如图所示。下列说法正确的是
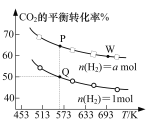
A.ΔH<0,a<1
B.正反应速率:υ(P)<υ(W),容器压强:p(P)<p(W)
C.P点时的化学平衡常数为512
D.若向Q点容器中再通入0.75mol H2和0.5mol H2O,反应将向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应速率和化学平衡、溶液pH影响的图像,其中图像和实验结论表达均正确的是

A.①是其他条件一定时,反应速率随温度变化的图像,正反应△H<0
B.②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是表示Cl2通入H2S溶液中pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是( )
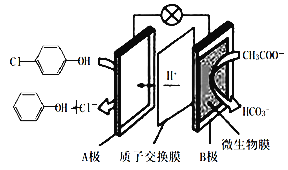
A.本装置集净化、供电于一体,产物之一还有消毒作用
B.每消耗1mol CH3COO-,通过质子交换膜的质子的物质的量为8mol
C.在该装置中,B极上的电势比A极上的电势高
D.A极的电极反应为![]() +H++2e-→
+H++2e-→![]() +Cl-
+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用KIO3溶液氧化酸性溶液中的KI:5I-+ IO3- + 3H2O = 3I2 + 6OH-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2![]()
C.Cu溶于稀HNO3:Cu + 2H+ + NO3- = Cu2+ + NO2↑+ H2O
D.Ca(HCO3)2溶液与足量NaOH溶液反应:2HCO3- + Ca2+ + 2OH-= CaCO3↓ + CO32-+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com