
| A. | c(SO3)=0.4 mol/L | B. | c(SO2)=c(SO3)=0.15 mol/L | ||
| C. | c(O2)=0.35 mol/L | D. | c(SO2)+c(SO3)=0.4 mol/L |
分析 对于反应2SO2(g)+O2(g)?2SO3(g),某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,可利用极限转化分析各物质的最大浓度,但由于反应为可逆反应,则各物质的浓度一定小于最大浓度,以此来解答.
解答 解:2SO2(g)+O2(g)?2SO3(g),
某时刻0.2mol/L 0.2mol/L 0.2mol/L
极限转化0.4mol/L 0.3mol/L 0
极限转化 0 0.1mol/L 0.4mol/L
A.由于反应为可逆反应,SO3的浓度一定小于0.4mol/L,故A错误;
B.SO3、SO2浓度不会均为0.15mol/L,只能一种物质的浓度增大,另一种物质的浓度减小,故B错误;
C.由于反应为可逆反应,O2的浓度一定小于0.3mol/L,则不可能为0.35mol/L,故C错误;
D.根据元素守恒定律,c(SO2)+c(SO3)=0.4mol/L,故D正确.
故选D.
点评 本题考查可逆反应,注意可逆反应的特点为不完全转化性,学生应学会利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度,难度不大.


科目:高中化学 来源: 题型:解答题
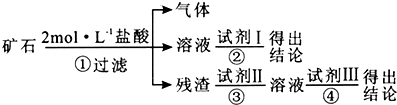
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取适量矿石研细,加 足量2 mol•L-1盐酸 | 有大量无色气体生成,得棕黄 色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
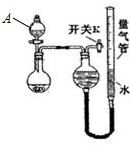 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0 g | 10.0 mL | 346.2 mL |
| ② | 2.0 g | 10.0 mL | 335.0 mL |
| ③ | 2.0 g | 10.0 mL | 345.8 mL |
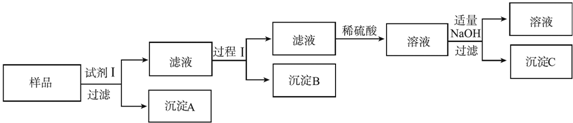
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO•3Fe2O3 | B. | 2FeO•3Fe2O3 | C. | FeO•2Fe2O3 | D. | 2FeO•Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
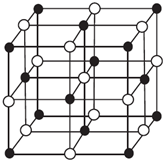 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
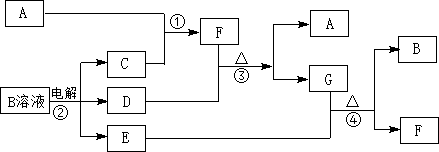 (1)写出化学式FNH3,
(1)写出化学式FNH3,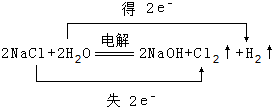 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
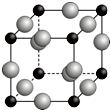 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com