
| A、①③⑤ | B、②④⑥ |
| C、⑤⑥⑦ | D、①③⑤⑥ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| B | 2P轨道上有二个孤电子 |
| C | 与B同主族 |
| D | 前四周期中金属性最强的元素 |
| E | 前四周期中原子核外孤电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①② |
| C、只有③ | D、全部错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、a点时溶液中所含主要溶质为(NH4)2SO4 |
| B、a→b段发生反应的离子方程式是:SO42-+Ba2+=BaSO4↓ |
| C、b点为最大沉淀量,对应的纵坐标值为0.2 |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28 g C2H4中含有2 NA个碳原子 |
| B、常温常压下,22.4L氦气含有的原子数为2NA |
| C、1mol S在足量O2中燃烧,转移的电子数为6 NA |
| D、0.1 mol?L-1的碳酸氢钠溶液中含钠离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、验证SO2具有氧化性:SO2气体通入酸性KMnO4溶液中 |
| B、从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取 |
| C、测定中和热:取50mL5mol/L的硫酸和50mL5mol/LNaOH中和,测定反应放出的热 |
| D、除去Mg(OH)2中的少量Ca(OH)2:加入足量的MgCl2溶液,充分反应后过滤洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
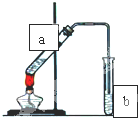 (Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.
(Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.| 催化剂 |
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com