
在一定条件下,密闭容器中可发生可逆反应:N2(g) + 3H2(g)  2NH3(g) 。
2NH3(g) 。
下列说法中,表明这一反应已经达到化学平衡状态的是
A.N2、H2、NH3的浓度相等 B.N2、H2、NH3的浓度不再变化
C.N2、H2、NH3在密闭容器中共存 D.反应停止,正、逆反应速率都等于零
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=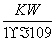 mol/L
mol/L
B.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长时间后,18O原子( )
2SO3,在混合气体中充入一定量的18O2,足够长时间后,18O原子( )
A.存在于SO2、O2、SO3中 B.只存在于SO2、O2中
C.只存在于O2、SO3中 D.只存在于SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2+O2 2SO3为放热反应,关于该反应的下列说法正确的是
2SO3为放热反应,关于该反应的下列说法正确的是
A.O2的能量一定高于SO2的能量 B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应放热,故不必加热反应就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施对增大反应速率明显有效的是
A.Al在氧气中燃烧生成A1203,将Al片改成Al粉 B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在H2S04与BaCl2两溶液反应时,增大压强 D.Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
正极电极反应式为____________ ____ 。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为________________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为 g
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___________ _____。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
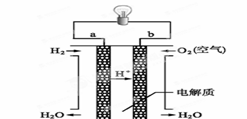
① 氢氧燃料电池的总反应化学方程式是:_________ ___。
② 电池工作一段时间后硫酸溶液的浓度____ _____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下:
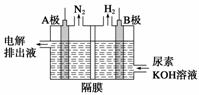
电解池中隔膜仅阻止气体通过,阴阳两极均为惰性电极。
(1)A极为________,电极反应式为________________________________________。
(2)B极为________,电极反应式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,属于同分异构体的是( )
A.O2和O3 B.16O和18O
C. CH3CH2OH和CH3OCH3 D. CH3CH2CH3和CH3(CH2)2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com