钨是属于有色金属,也是重要的战略金属,钨矿在古代被称为“重石”.1783年被西班牙人德普尔亚发现黑钨矿也从中提取出钨酸,同年,用碳还原三氧化钨第一次得到了钨粉,并命名该元素.钨是的用途十分广,涉及矿山、冶金、机械、建筑、交通、电子、化工、轻工、纺织、军工、航天、科技、各个工业领域.现在高温下,在密闭容器中用H
2还原WO
3可得到金属钨,其总反应为:WO
3(s)+3H
2(g)
W(s)+3H
2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为______.
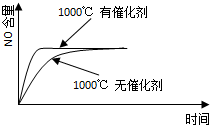
(2)某温度下反应达平衡时,H
2与水蒸气的体积比为2:3,则H
2的平衡转化率为______;随温度的升高,H
2与水蒸气的体积比减小,则该反应正反应为______反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3W2O5WO2W |
第一阶段反应的化学方程式为______;580℃时,固体物质的主要成分为______;假设WO
3完全转化为W,则三个阶段消耗H
2物质的量之比为______
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I
2可延长灯管的使用寿命,其工作原理为:W(s)+2I
2(g)
WI
4(g).下列说法正确的有______.
A.灯管内的I
2可循环使用
B.WI
4在灯丝上分解,产生的W又沉积在灯丝上
C.WI
4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI
4的分解速率加快,W和I
2的化合速率减慢.



 阅读快车系列答案
阅读快车系列答案