
| A. | 二氧化碳可与氢气在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| B. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| C. | 利用电解原理可制备Na、Mg、Al等活泼金属,也可实现N2和H2合成NH3 | |
| D. | 研究发现出土的青铜器表面若有白色的CuCl,会加快青铜器的腐蚀速率,这是因为CuCl作为催化剂降低了腐蚀反应的活化能 |
分析 A.二氧化碳转化为燃料和化工原料可以减少二氧化碳的排放;
B.燃煤烟气中的二氧化硫用碱性溶液吸收;
C.电解法用于冶炼活泼金属,也可以电解N2和H2合成NH3;
D.催化剂能降低反应所需的活化能.
解答 解:A.二氧化碳转化为燃料和化工原料可以减少二氧化碳的排放,所以二氧化碳可与氢气在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,可以减少 二氧化碳的排放,符合低碳经济的发展要求,故A正确;
B.燃煤烟气中的二氧化硫用碱性溶液吸收,二氧化硫与碱反应生成亚硫酸盐,发生化学反应,故B错误;
C.电解法用于冶炼活泼金属,也可以电解N2和H2合成NH3,即利用电解原理可制备Na、Mg、Al等活泼金属,也可实现N2和H2合成NH3,故C正确;
D.青铜器表面若有白色的CuCl,会加快青铜器的腐蚀速率,这是因为CuCl作为催化剂降低了腐蚀反应的活化能,使反应速率加快,故D正确.
故选B.
点评 本题考查了低碳经济、二氧化硫、电解原理的应用、催化剂对反应速率的影响等,题目难度不大,侧重于考查化学知识在生产生活中的应用,注意相关知识的积累.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
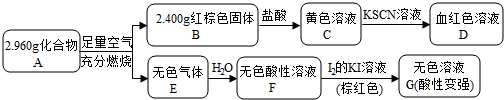
 ,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;
,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密封保存的46 g NO2气体含有分子数小于NA | |
| B. | 标准状况下,22.4 LCCl4中含有的氯原子数目为4NA | |
| C. | 18gT2O(3H2O)中,含有的电子总数为10NA | |
| D. | 含NA个Na+的Na2O2溶于1 L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,则反应释放能量 | |
| B. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 | |
| C. | 钠原子与氯原子结合生成氯化钠后,其结构的稳定性增强,体系的能量降低 | |
| D. | 当断开旧键吸收的能量大于形成新键放出的能量时,该反应为吸收能量的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓溴水反应制取溴苯 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 1 mol•L-1 CuSO4溶液2mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 向稀苯酚中加浓溴水观察沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
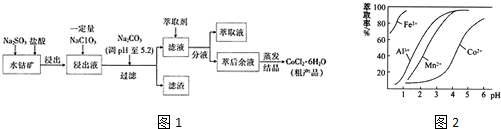
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com