
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O${\;}_{2}^{2-}$与S2-具有相同的质子数和电子数 | |
| C. | 氕、氘、氚分别与O原子形成的水H2O、D2O、T2O的化性质不同 | |
| D. | 形成离子键的阴阳离子间只存在静电吸引力 |
分析 A、ⅤA族元素,最高价为+5价,N元素的最高价氧化物对应水化物的化学式为HNO3;
B、O22-与S2-的质子数均为16和电子数均为18;
C、H、D、T属于同位素,是同一种元素;
D、原子核之间存在斥力.
解答 解:A、ⅤA族元素,最高价为+5价,N元素的最高价氧化物对应水化物的化学式为HNO3,故A错误;
B、O22-与S2-的质子数16和电子数为18,所以两种微粒具有相同的质子数和电子数,故B正确;
C、H、D、T属于同位素,是同一种元素,则氕、氘、氚分别与O原子形成的水H2O、D2O、T2O的化性质相,故C错误;
D、形成离子键的阴阳离子间存在静电吸引力,原子核之间存在斥力,故D错误,
故选B.
点评 本题考查原子结构与性质,难度不大,注意同位素的化学性质几乎完全相同.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 初始浓度/(mol•L-1) | 初始速率/mol•L-1s-1 | |
| c(NO) | c(O2) | |
| 0.010 | 0.010 | 2.5×10-3 |
| 0.010 | 0.020 | 5.0×10-1 |
| 0.030 | 0.020 | 4.5×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 降低温度 | D. | 锌片改为锌粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
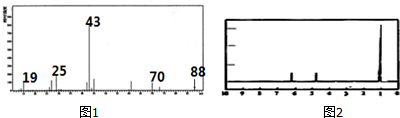
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和晶体硫的熔融 | B. | 石墨和食盐的熔化 | ||
| C. | 晶体碘和晶体二氧化碳的升华 | D. | 冰的融化和硝酸钠的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
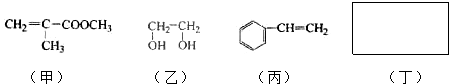
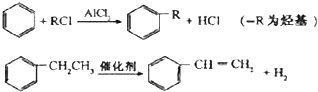
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | AlCl3 和NaOH | C. | 氩和P4 | D. | 金刚石和水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com