
【题目】下图是乙酸乙酯的合成路线图,已知B的水溶液可以溶解CaCO3,E可作果实催熟剂。
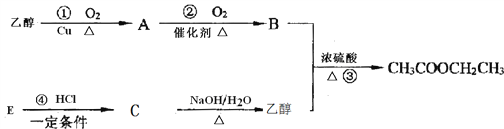
请完成下列问题:
(1)A的名称是_______;B中所含的官能团是__________;E的结构简式为___________________ 。
(2)反应③的反应类型是________;反应④的反应类型是_________________。
(3)写出CH3COOCH2CH3的同分异构体(含有酯基)______________________。
(4)请写出以下反应化学方程式:
A、合成路线①的方程式为____________________;
B、成路线④的方程式为_____________________;
C、物质E在一定条件下发生加聚反应的化学反应方程为___________________________;
D、写出乙酸乙酯在NaOH溶液中的水解反应方程式______________________;
E、写出B的水溶液溶解CaCO3的方程式________________________。
(5)如果用4.6 g的乙醇和9.0 g的B反应制得乙酸乙酯5.28 g。则本实验的产率是:__________(产率指的是某种生成物的实际产量与理论产量的比值)。
【答案】 乙醛 羧基(或—COOH) CH2=CH2 酯化(或取代反应) 加成反应 CH3CH2COOCH3; HCOOCH2CH2CH3; HCOOCH(CH3)CH3 2CH3CH2OH + O2![]() 2CH3CHO+2H2O CH2=CH2 + HCl
2CH3CHO+2H2O CH2=CH2 + HCl![]() CH3CH2Cl
CH3CH2Cl ![]() 【答题空10】CH3COOCH2CH3+NaOH--> CH3CH2OH+CH3COONa 2CH3COOH +CaCO3 --> (CH3COO)2Ca + H2O 60%
【答题空10】CH3COOCH2CH3+NaOH--> CH3CH2OH+CH3COONa 2CH3COOH +CaCO3 --> (CH3COO)2Ca + H2O 60%
【解析】(1)乙醇发生催化氧化生成乙醛,则A的名称是乙醛;乙醛继续被氧化生成乙酸,即B是乙酸,B中所含的官能团是羧基;E和氯化氢反应生成氯乙烷,E可作果实催熟剂,则E是乙烯,结构简式为CH2=CH2。(2)乙醇和乙酸发生酯化反应生成乙酸乙酯,则B是乙醇,所以氯乙烷水解生成乙醇,乙烯和HCl加成反应生成氯乙烷,综上,反应③为酯化反应,反应④为加成反应。(3)与乙酸乙酯互为同分异构体的酯类化合物是HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3CH2COOCH3。(4)①是乙醇的催化氧化,方程式为2CH3CH2OH + O2![]() 2CH3CHO+2H2O;④是乙烯和氯化氢的加成反应,方程式为CH2=CH2 + HCl
2CH3CHO+2H2O;④是乙烯和氯化氢的加成反应,方程式为CH2=CH2 + HCl![]() CH3CH2Cl;E是乙烯在一定条件下发生加聚反应的化学反应方程为:
CH3CH2Cl;E是乙烯在一定条件下发生加聚反应的化学反应方程为:![]() ;乙酸乙酯在NaOH溶液中的水解生成乙醇和乙酸钠,化学方程式为:CH3COOCH2CH3+NaOH→CH3CH2OH+ CH3COONa;B是乙酸,与CaCO3反应的化学方程式为:2CH3COOH +CaCO3 →(CH3COO)2Ca + H2O。(5)4.6 g的乙醇(1mol)和9.0 g的B反应理论上生成1mol乙酸乙酯(88g),因实际制得乙酸乙酯5.28 g,所以产率为:5.28 g÷88g×100%=60%。
;乙酸乙酯在NaOH溶液中的水解生成乙醇和乙酸钠,化学方程式为:CH3COOCH2CH3+NaOH→CH3CH2OH+ CH3COONa;B是乙酸,与CaCO3反应的化学方程式为:2CH3COOH +CaCO3 →(CH3COO)2Ca + H2O。(5)4.6 g的乙醇(1mol)和9.0 g的B反应理论上生成1mol乙酸乙酯(88g),因实际制得乙酸乙酯5.28 g,所以产率为:5.28 g÷88g×100%=60%。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法。下列分类合理的是
A. HC1和H2SO4都属于酸 B. K2CO3和K2O都属于盐
C. NaOH和Na2CO3都属于碱 D. H2O和O2都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4· H 2O(三盐),主要制备流程如下。

(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为_________。若铅蓄电池放电前正、负极质量相等,放电时转移了lmol电子,则理论上两极质量之差为___________。
2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为_________。若铅蓄电池放电前正、负极质量相等,放电时转移了lmol电子,则理论上两极质量之差为___________。
(2)将滤液I、滤液III合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物( Mr=322) ,其化学式为______________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO的离子方程式为_____________;滤液II中溶质的主要成分为________(填化学式)。
(4)步骤⑥合成三盐的化学方程式为____________ 。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种金属,A中混有C时A先腐蚀,A与B组成原电池,A为电池正极,则A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是
A. Fe2+、H+、Cl-、NO3- B. K+、NH4+、OH-、Cl-
C. NH4+、Na+、Br-、SO42- D. Mg2+、H+、SiO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用的KNO3的性质是
A. 自燃性 B. 易分解 C. 还原性 D. 氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛化合物常见价态有+2和+4。钛白粉(TiO2,两性氧化物)用途广泛。工业上由高钛渣(主要成分为Ti3O5,还含有TiO2、Fe2O3等)制取钛白粉的主要工艺过程如下:
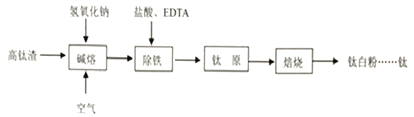
(1)写出碱熔步骤所发生反应的化学方程式____________、____________。
(2)实验测定EDTA加入量(EDTA和Fe3+的物质的量之比)对 Ti4+和Fe3+溶出率的影响如图所示。由图可知,EDTA的加入量为____________时除铁效率最佳,理由是____________。

(3)在实验室模拟除铁净化后的实验步骤:①向钛原料中加入稀硫酸生成偏钛酸(H2TiO3)沉淀,反应结束后过滤;②洗涤;③……;④在650℃下高温焙烧得到较纯的钛白粉固体。步骤③的实验目的是____________,需要用到的试剂有____________。
(4)测定钛白粉纯度:称取试样0.200g在CO2气氛下用金属铝将钛(IV)还原成钛(Ⅲ),还原后的溶液以NH4SCN为指示剂,用0.08mol/L的 NH4Fe(SO4)2标准液滴定,滴定终点时消耗标准液29.20mL,钛白粉的纯度为____________。(保留三位有效数字)
(5)最新研究发现也可以用图示装置由TiO2获得金属钛。装置中阳极的电极反应方程式为____________,在制备金属钛前后,整套装置中CaO的总量____________(填写“增大”、“减小”或者“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 熟石灰用于燃煤烟气脱硫
B. 硅常用作光导纤维
C. 碳酸钠治疗胃酸过多
D. 用FeCl2溶液与Cu反应制作印刷电路板
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com