
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
请回答:
(1)以上元素中,最高价氧化物对应水化物酸性最强的是;碱性最强的是;显两性的是(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物; ⑨的最高价氧化物的对应的水化物;
(4)由H和①形成的原子数之比为1:1的物质(填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为 .
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是; .
【答案】
(1)HClO4;KOH;Al(OH)3
(2)K>Na>Mg
(3)![]() ;
;![]()
(4)H2O2
(5)2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O
(6)Al(OH)3+OH﹣=AlO2﹣+2H2O;Al(OH)3+3H+=Al3++3H2O
【解析】解:由元素在周期表中的位置可知,①是S、②是F、③是Na、④是Mg、⑤是Al、⑥是P、⑦是S、⑧是Cl、⑨是K.(1)F元素没有最高价含氧酸,最高价氧化物对应水化物酸性最强的是高氯酸;K的金属性最强,故KOH的碱性越强;Al(OH)3是两性氢氧化物;所以答案是:HClO4;KOH;Al(OH)3;(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,所以答案是:K>Na>Mg;(3)⑥的氢化物为PH3 , P原子与H原子之间形成1对共用电子对,电子式为 ![]() ; ⑨的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,电子式为
; ⑨的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,电子式为 ![]() , 所以答案是:
, 所以答案是: ![]() ;
; ![]() ;(4)由H和①形成的原子数之比为1:1的物质为H2O2 , 所以答案是:H2O2;(5)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,反应方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;(6)⑤的最高价氧化物对应水化物为Al(OH)3 , ③、⑧的最高价氧化物对应水化物分别为NaOH、HClO4 , 氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,与高氯酸反应生成 高氯酸铝与水,离子方程式分别为:Al(OH)3+OH﹣=AlO2﹣+2H2O、Al(OH)3+3H+=Al3++3H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;Al(OH)3+3H+=Al3++3H2O.
;(4)由H和①形成的原子数之比为1:1的物质为H2O2 , 所以答案是:H2O2;(5)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,反应方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;(6)⑤的最高价氧化物对应水化物为Al(OH)3 , ③、⑧的最高价氧化物对应水化物分别为NaOH、HClO4 , 氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,与高氯酸反应生成 高氯酸铝与水,离子方程式分别为:Al(OH)3+OH﹣=AlO2﹣+2H2O、Al(OH)3+3H+=Al3++3H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;Al(OH)3+3H+=Al3++3H2O.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式:
(1)![]() .
.
(2)CH3CH(CH3)C(CH3)2(CH2)2CH3 .
(3)2,5﹣二甲基﹣4﹣乙基庚烷 .
(4)2﹣甲基﹣2﹣戊烯
(5)键线式 ![]() 表示的分子式;一氯代物有 .
表示的分子式;一氯代物有 .
(6)![]() 中含有的官能团的名称为 .
中含有的官能团的名称为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 可用过滤的方法将悬浊液中的分散质从分散剂中分离出来
B. 任何物质在水中都有一定的溶解度
C. 同一种溶质的饱和溶液要比不饱和溶液的浓度大
D. 布朗运动是胶体粒子特有的运动方式,只用肉眼就可以把胶体、溶液和浊液区别开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图1所示装置可以完成一系列实验(图中夹持装置已略去). 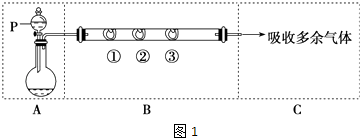
用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的三处棉花依次做了如下处理:①包有某固体物质,②蘸有KI溶液,③蘸有石蕊溶液.
请回答下列问题:
(1)仪器P的名称是;
(2)①处包有的某固体物质可能是(填序号); a.MnO2 b.KMnO4 c.KCl d.Cu
反应开始后,观察到②处有棕黄色物质产生,在实验过程中,在③处能观察到;
(3)甲同学为了验证剩余气体的主要成分,在C中设计了如图2装置,D中装有铜丝网,装置E的试管中不加任何试剂,装置F的烧杯中加入适量的AgNO3溶液 ①实验过程中,装置D的作用是
②装置F中的现象是;
③乙同学认为甲同学的实验有缺陷,为了确保实验的可靠性,乙同学提出在和(填装置字母)之间加装如图3所示装置.你认为如图3广口瓶中可加入足量(填字母代号),此试剂的作用是 . 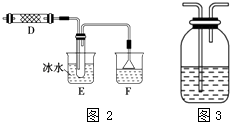
A.淀粉﹣碘化钾溶液 B.四氯化碳溶液 C.湿润的有色布条 D.饱和食盐水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2 ![]() 2NH3 . 下列关于该反应的说法正确的是( )
2NH3 . 下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3
B.增大压强能使反应速率减小
C.降低反应体系的温度能加快反应速率
D.向容器中再加入N2 , 能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
(1)根据题意解答 (i)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应的速度最慢;与盐酸反应产生的气体最多.
(ii)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律: 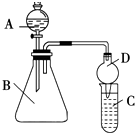
(i)仪器B的名称为 , 干燥管D的作用为 .
(ii)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(iii)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶除去.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. Al2O3熔点高,可用作耐高温材料
B. SO2具有氧化性,可用于漂白纸浆
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4,下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有下列键型的物质,可能为单质的是
A. 只有离子键的物质 B. 既有离子键,又有非极性键的物质
C. 既有极性键,又有离子键的物质 D. 只有非极性键的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com