
【题目】关于下列一组图示的说法中正确的是( ) 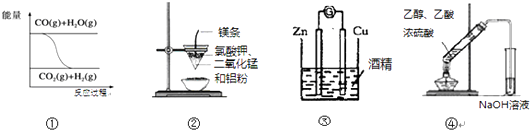
A.图①表示可逆反应“CO(g)+H2O(g)CO2(g)+H2(g)”为吸热反应
B.图②可以制取金属锰
C.图③形成原电池
D.图④制取乙酸乙酯
【答案】B
【解析】解:A.图①中一氧化碳和水的能量高于生成物二氧化碳和氢气的能量,不能表示可逆反应“CO(g)+H2O(g)CO2(g)+H2(g)”为吸热反应,故A错误; B.图②表示的是铝热反应,铝和二氧化锰在引发剂作用下反应生成金属锰,3MnO2+4Al ![]() 3Mn+2Al2O3 , 可以制取金属锰,故B正确;
3Mn+2Al2O3 , 可以制取金属锰,故B正确;
C.酒精是非电解质,装置中不能形成闭合回路,不能形成原电池反应,故C错误;
D.装置图中导气管应在溶液液面上,试管中应为饱和碳酸钠溶液,乙酸乙酯在氢氧化钠溶液中会发生水解,故D错误;
故选B.
【考点精析】利用吸热反应和放热反应对题目进行判断即可得到答案,需要熟知化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】可再生能源和清洁能源将成为新能源的主力军,下列关于能源的叙述正确的是
A.化石燃料是可再生能源B.氢能、太阳能是清洁能源
C.化石燃料都是清洁能源D.海洋能、地热能是不可再生的清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3 + 3ClO- + 4OH-=2RO4n- + 3Cl- + 5H2O,则RO4n-中R的化合价是
A.+6B.+5C.+4D.+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)所测土壤的酸碱性如何?
(2)所用氨水的pH和c(OH﹣)分别为多少?
(3)为使该滤液呈中性,所加入氨水的恰当体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaHCO3溶液中混有的Na2CO3,下列方法中应采用的是 ( )
A. 加入过量的HCl溶液
B. 通入过量的CO2气体
C. 加入过量的Ca(HCO3)2溶液
D. 将溶液进行加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.3 mol氧气和0.2 mol臭氧(O3)的
A. 分子数相等 B. 体积相等
C. 标准状况下体积比是2:3 D. 标准状况下的体积比是3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
a.Na2O2 b.HNO3 c.FeCl3 d.KMnO4
(2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子__________(填序号)。
a.Fe3+ b.Al3+ c.Ca2+ d.Mg2+
II.酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。该法用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3
(3)电解时连接铁棒的一极是电源的_________极。
(4)写出电解时阳极的电极反应式____________________;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________;
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至1×10-5molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:

注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。

则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com