
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水。

(1)A中在加热至85℃反应,反应的化学方程式为______,该实验装置不够完善,可以改进之处为___________。为了完成实验,装置从左到右接口的链接顺序是____![]() _____。
_____。
(2)制得的氨水可用于在实验室模拟工业制硝酸的过程,装置如下(夹持装置略去)

① 装置B中反应的化学方程式是:_______。
② 请在装置图方框处画出必要仪器,并指出所加试剂________。
③ 装置D中发生反应的化学方程式为_____________。开始反应一段时间后,撤离热源反应也可以持续进行,原因为__________。
④ 某同学认为在装置F中可能出现白烟,应在装置D和装置F之间增加下列装置中的______(填序号),从而避免此现象发生,提高硝酸的产率。利用改进后的装置进行实验,装置F中发生反应的化学方程式为__________。

⑤ 该装置还应在______之后添加________装置。
【答案】 NH4Cl+NaNO2![]() N2↑+NaCl+H2O 水浴加热 blh fgkjl CaO+NH3·H2O=NH3↑+Ca(OH)2
N2↑+NaCl+H2O 水浴加热 blh fgkjl CaO+NH3·H2O=NH3↑+Ca(OH)2 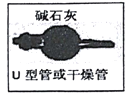 4NH3+5O2
4NH3+5O2![]() 4NO+6H2O 该反应为放热反应,反应放出的热量可维持反应的继续进行 a 2NO + O2 = 2NO2 G 尾气处理
4NO+6H2O 该反应为放热反应,反应放出的热量可维持反应的继续进行 a 2NO + O2 = 2NO2 G 尾气处理
【解析】试题分析:(1)A中氯化铵和亚硝酸钠加热至85℃生成氮气、氯化钠、水;为便于控制温度,最好用水浴加热; 模拟制取氨气,用A制取氮气、B制取氢气(除去氯化氢),通入浓硫酸中充分混合并干燥,在通入盛有催化剂的玻璃管中合成氨气,通入水中制备氨水,最后尾气处理;(2)①B中氧化钙与氨水反应生成氢氧化钙和氨气; ②氨气通入高温加热的玻璃管前必须干燥;③ D中氨气被氧化为NO和水;氨气的催化氧化为放热反应,反应放出的热量可维持反应的继续进行;④出现白烟是生成硝酸铵, ![]() ,
, ![]() ,除去水蒸气可以避免此现象发生。装置F中NO被氧气氧化为NO2;⑤ 该装置还缺少尾气处理装置。
,除去水蒸气可以避免此现象发生。装置F中NO被氧气氧化为NO2;⑤ 该装置还缺少尾气处理装置。
解析:(1)A中氯化铵和亚硝酸钠加热至85℃生成氮气、氯化钠、水,反应的方程式是NH4Cl+NaNO2![]() N2↑+NaCl+H2O;为便于控制温度,最好改为水浴加热。
N2↑+NaCl+H2O;为便于控制温度,最好改为水浴加热。
模拟制取氨气,用A制取氮气、B制取氢气(除去氯化氢)后,通入浓硫酸中充分混合并干燥,再通入盛有催化剂的玻璃管中合成氨气,通入水中制备氨水,最后尾气处理,仪器的连接顺序是 ;
;
(2)①B中氧化钙与氨水反应生成氢氧化钙和氨气,反应方程式是CaO+NH3·H2O=NH3↑+Ca(OH)2;
②氨气通入高温加热的玻璃管前必须干燥,所以C是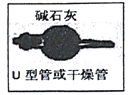 ;
;
③ D中氨气被氧化为NO和水,反应方程式是4NH3+5O2![]() 4NO+6H2O;氨气的催化氧化为放热反应,反应放出的热量可维持反应的继续进行,所以开始反应一段时间后,撤离热源反应也可以持续进行;
4NO+6H2O;氨气的催化氧化为放热反应,反应放出的热量可维持反应的继续进行,所以开始反应一段时间后,撤离热源反应也可以持续进行;
④出现白烟是生成硝酸铵, ![]() ,
, ![]() ,为避免此现象发生,可以除去NO中的水蒸气,在装置D和装置F之间增加装有干燥剂
,为避免此现象发生,可以除去NO中的水蒸气,在装置D和装置F之间增加装有干燥剂![]() 的干燥管,所以选a。装置F中NO被氧气氧化为NO2,反应方程式是2NO + O2 = 2NO2;
的干燥管,所以选a。装置F中NO被氧气氧化为NO2,反应方程式是2NO + O2 = 2NO2;
⑤ 该装置还缺少尾气处理装置,所以在G之后添加尾气处理装置。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅱ]由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为某实验小组依据氧化还原反应(用离子方程式表示)________设计的原电池装置。反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。

(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:__________。
(3)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点_________ (填“升高”还是“降低”),△H______(填“变大”、“变小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。

部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式__________________________。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中 间体(如图)。其中a、c二步的化学方程式可表示为__________________________,____________________________________。
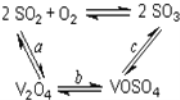
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。

根据图试建议控制氯化铵系数和温度:_____________、______________。
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如
图所示。则NH4VO3在分解过程中____________。

A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境问题的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过104%的空气有利于人体健康
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com