
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l) △H<0
N2O3(l) △H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。

(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向______ _移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
(1)1.1×10-3 mol·L-1·s-1(3分,单位、有效数字错漏合扣1分)
(2)①减小(2分) ②正向(2分) (3)、(4)(如图,各2分,共4分,注意曲线起点、斜率、平衡点要素有错,每个要素扣1分直至0分,使用催化剂不标注扣1分)

(5)NO + NO2 + 2OH―=2NO2―+ H2O(3分); NO2(2分)
【解析】
试题分析:(1)根据前20s内,NO2浓度的变化量为0.040mol/L-0.018mol/L=0.022mol/L,则反应速率v=0.022mol/L÷20s=1.1×10-3 mol?L-1?s-1;
(2)①△H<0,该反应放热,升高温度向逆反应方向移动,NO2的转化率减小;
②反应前气体体积大于反应后气体体积,增大压强向正反应方向进行,故答案为:正向;
(3)反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L,画出平滑曲线,故答案为:
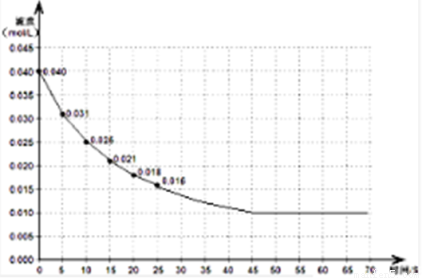 ;
;
(4)加入催化剂,加快反应速率,达到化学平衡时,所需时间缩短,且平衡浓度不变,画出平滑曲线,故答案为: ;
;
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该盐的化合价介于NO、NO2的化合价之间,则化合价为+3价,为亚硝酸盐,根据氧化还原化学方程式配平,写出离子方程式:NO+NO2+2OH-=2NO2-+H2O; NO2化合价降低,为氧化剂。
考点:考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:选择题
某温度时,向三个体积相等的恒容密闭容器A、B、C中,分别加入① 2 mol HI;②3mol HI;③ 1mol H2与1mo1 I2;发生反应2HI (g)  H2(g)+I2(g),分别达平衡时,以下关系正确的是
H2(g)+I2(g),分别达平衡时,以下关系正确的是
A.平衡时,各容器的压强:②=①=③
B.平衡时,I2的浓度:②>①=③
C.平衡时,I2的体积分数:②>①=③
D.从反应开始到达平衡的时间:②>①
查看答案和解析>>
科目:高中化学 来源:2014秋季甘肃省高二第一学期期中考试文科化学试卷(解析版) 题型:选择题
日常生活中遇到的很多问题都涉及到化学知识,下列有关叙述不正确的是
A.用食醋清洗热水瓶中的水垢
B.用米汤检验碘盐中的碘
C.用纯碱溶液洗涤餐具上的油污
D.利用丁达尔现象区别蛋白质溶液和食盐水
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
下列关于化学平衡常数的说法,
A.在任何条件下,化学平衡常数都是一个定值.
B.改变浓度,平衡常数会变
C.同条件下,平衡常数只与温度有关.
D.化学平衡发生移动,平衡常数必定发生改变.
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
.在溶液中发生的反应,对反应速率不发生影响的因素是
A.温度 B.压强 C.浓度 D.催化剂
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:选择题
下列陈述I、 II正确并且有因果关系的是( )
选项 | 叙述I | 叙述II |
A | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
B | Ba(OH)2可与盐酸反应 | Ba(OH)2可用于治疗胃酸过多 |
C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
D | H2O2有氧化性 | H2O2能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:填空题
(16分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
① CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
② CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。

假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应②生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
A.c ( H2 )减少;
B.平衡常数K增大;
C.CH3OH 的物质的量增加;
D.正反应速率加快,逆反应速率减慢;
E.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用图装置模拟上述过程,

则: Co2+在阳极的电极反应式为: ;除去甲醇的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:选择题
常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7, 下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:填空题
(10分)某化学探究学习小组同学在实验室中配制100mL 0.5mol/L的Na2CO3溶液。
(1)下列实验步骤是配制溶液所必需的步骤,请使用各步骤的编号按照实验操作时的顺序进行排序(填写各步骤的编号)_______________________;
①溶解 ②定容 ③计算 ④转移 ⑤称量 ⑥洗涤并转移 ⑦反复倒转摇匀
(2)实验中除了需要天平、药匙、烧杯、玻璃棒外,还需要的仪器有_______________;
(3)用碳酸钠晶体(Na2CO3·10H2O)配制该溶液需要 g,若称取等质量的Na2CO3 ,则所配制溶液的浓度 (填写偏高、偏低、无影响);
(4)该小组在实验室中发现了一张注射用质量分数为5%的葡萄糖(分子式为C6H12O6,相对分子质量为180)溶液的标签,如下图所示:

该溶液的物质的量浓度为________(小数点后保留2位数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com