
| 实验内容 | 实验现象 | 相关解释 | |
| A | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性. |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硝酸足量,铜的质量相等且溶液体积相等,则反应后铜离子的浓度相等;
B.该反应为氧化还原反应,生成产物为氯化铵和氮气;
C.氢氧化铁胶粒带电荷,开始时发生聚沉,之后氢氧化铁与稀盐酸发生中和反应;
D.二氧化氮的体积较大,带火星木条复燃,能够证明乙醛和二氧化氮都助燃.
解答 解:A.将等质量的铜片分别与等体积、过量的浓硝酸和过量的稀硝酸反应后,所得溶液中Cu2+的浓度基本相等,颜色基本相同,不可能是c(Cu2+)浓度差异引起的,若溶液呈“绿色”可能是溶液中Cu2+与NO2共存的结果,故A错误;
B.NH3与Cl2混合除了生成氯化铵,还会有氮气生成,不属于化合反应,故B错误;
C.往Fe(OH)3胶体中逐滴滴入稀盐酸,先发生聚沉现象生成氢氧化铁沉淀,会出现红褐色沉淀,后Fe(OH)3与HCl反应生成氯化铁和水,沉淀溶解,故C正确;
D.反应2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑中二氧化氮的体积为氧气体积的4倍,生成红棕色气体证明有二氧化氮,带火星木条复燃说明氧气和NO2都有助燃性,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及氧化还原反应、胶体性质、性质实验评价等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
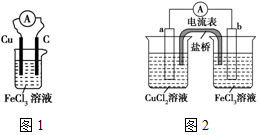 实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.
实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
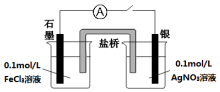 甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:
甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 物质的量之比为2:3的稀硝酸和稀硫酸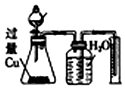 | 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
| C | 向1mL浓度均为0.05mol•L-1NaCl、NaI的混合溶液中滴加2滴0.01mol•L-1 AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
| D | 室温下,用pH试纸测得0.1mol•L-1NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物是重要的化工原料,在工农业生产应用广泛.
硫及其化合物是重要的化工原料,在工农业生产应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
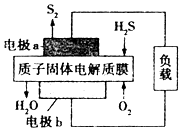 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )| A. | 电池工作时,电子从电极a经质子固体电解质膜流向电极b | |
| B. | 电极a上发生的电极反应为2H2S+4OH--4e-═S2+4H2O | |
| C. | 当电路中通过2 mol电子时,有2 mol H+经质子固体电解质膜进入正极区 | |
| D. | 当反应中生成64 g S2时,电池内部有632KJ的能量转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要用到的仪器是酒精灯,烧杯,温度计,量筒,环形玻璃搅拌棒 | |
| B. | 中和热测定可以是所有的酸和碱 | |
| C. | 环形玻璃搅拌棒的搅拌方式是上下搅动 | |
| D. | 实验所取NaOH物质的量稍大于HCl,会导致中和热的数值偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com