
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
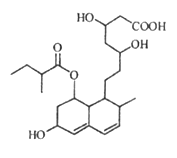
A. 1mol该物质最多可与2molNaOH反应
B. 能发生加成、取代、不能发生消去反应
C. 不能使溴水褪色
D. 能与FeCl3溶液发生显色反应
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价氧化物对应的水化物反应生成离子化合物,下列判断正确的是( )
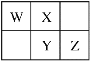
A.自然界存在游离态的W、X、Y
B.简单氢化物的稳定性:Y>Z
C.Z元素的氧化物对应的水化物的酸性一定强于Y
D.W元素的单质在化学反应中只能表现还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
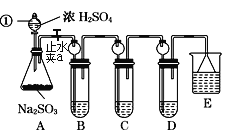
(1)指出仪器①的名称:___。
(2)装置B检验SO2的氧化性,则B中所盛试剂可以为___。
(3)装置C中盛装溴水用以检验SO2的___性,则C中反应的离子方程式为___。
(4)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为___;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的试剂:0.5mol·L-1HCl、0.5 mol·L-1H2SO4、0.5mol·L-1BaCl2、1mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:___。
第2步,用另一只干净试管取少量沉淀样品,加入___(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有___的试管中。若出现固体完全溶解,出现气泡,且该溶液褪色现象,则假设一成立。
(5)装置E中盛放的试剂是__,作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图所示,下列叙述正确的是( )
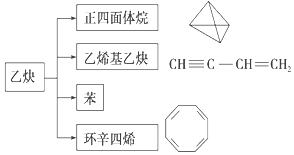
A. 正四面体烷的二氯代物只有1种
B. 乙炔生成乙烯基乙炔是取代反应
C. 由乙炔制得的四种有机物的含碳量不同
D. 苯乙烯与环辛四烯分子式不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:
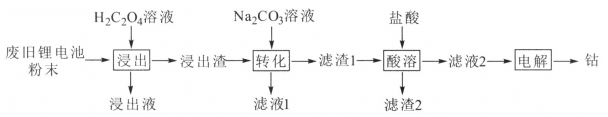
已知:Ksp(CoC2O4)=6.0×10-8,Ksp(CoCO3)=1.5×10-13。
回答下列问题:
(1) LiCoO2中,Co元素的化合价为______________。
(2)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为__________,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(3)“转化”中加入Na2CO3溶液发生反应的离子方程式为______________,该反应进行的程度较大,试通过计算其平衡常数K并解释原因______________。
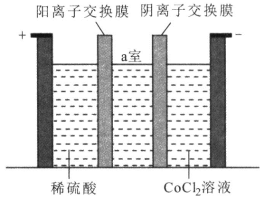
(4)“电解”时装置如图所示。阳极的电极反应式为_______,电解后a室中的电解液可返回工序继续使用。
(5)某废旧锂电池粉末中LiCoO2的质量分数为49%,将50吨该废料进行回收利用,电解得到钴5.9吨,则钴的回收率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙醇的催化氧化,某教师设计了如图所示装置,试回答以下问题:

(1)实验开始时打开a、b处活塞,B、E、F及各处导管均无堵塞现象,发现分液漏斗中的双氧水只流下少许后便停止流下,可能原因是:______,C装置中热水的作用是:_____。
(2)从M管中可观察到的现象:交替通入氧气和乙醇气体,铜丝交替出现____的颜色变化。写出M中发生反应的总方程式:__________。
(3)用Ag(NH3)2OH验证乙醇催化氧化产物的化学方程式为_________。
(4)乙醇除了能发生催化氧化,还可以发生消去反应,乙醇发生消去反应的条件是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体有单质、二元化合物、三元化合物等之分,其中三元半导体CuAlO2(或Cu2Al2O4)的制取,常采用CuO与Al2O3或Al(OH)3共热的方法。试分析并回答:
(l)试完成如下化学方程式:
_______CuO+_______ Al2O3![]() _______Cu2Al2O4+_______ ↑
_______Cu2Al2O4+_______ ↑
(2)上述反应能发生的理由主要是_____________。
(3)Al(OH)3有碱式和酸式两种电离方式,若25℃时,其酸式电离为Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-
AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-![]() AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
(4)经实验测定,“AlO2-” 的形式应该是[Al(OH)4]-,则AlCl3溶液与Na[Al(OH)4]溶液作用的离子方程式是_________________。
(5)用石墨电极电解Na[Al(OH)4] 溶液是制取高品质用Al(OH)3的方法之一。该电解反应的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在医药、照相、橡胶、染料、气象等许多领域都具有广泛的用途,海洋中虽然含碘的浓度相当小,每升海水中平均含碘0.06mg,但海洋里碘的总储量仍很惊人——9.3×1010t,比陆地上要多得多。一般生长在海底的海带含碘0.3%~0.5%,有的可达1%,比海水中碘的浓度高出十几万倍!海藻中含有丰富的碘元素(以I-形式存在)。实验室提取碘的流程如下:
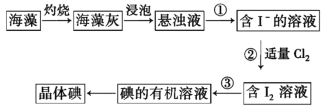
(1)实验操作①的名称是_________,实验操作③所用主要仪器名称为____________,实验②发生的离子反应方程式为 ___________________。
(2)提取碘的过程中,可供选择的有机试剂是___________(填序号)。
A.四氯化碳(沸点77℃) B.酒精(沸点78℃) C.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消耗此杂质,使碘全部游离出来,应加入适量_________(填序号)溶液,反应的离子方程式为___________。
A.KIO3 B.HClO C.Br2 D.KI
(4)为使从含碘有机溶液中提取碘并回收溶剂,采用水浴加热蒸馏(如图所示)。请指出图中实验装置除未加沸石外的错误之处(有处填几处,下列空白可不填满,也可补充)。
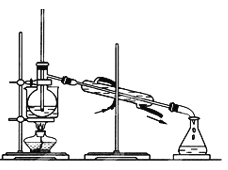
①____________
②____________
③____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
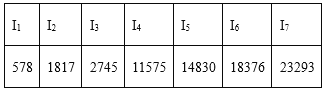
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为:![]()
C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D. 某主族元素的电离能I1~I7数据如上表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅢA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com