
 硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题.
硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题.| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si+2CO↑ |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
分析 (1)石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳,还原炉中SiHCl3和氢气发生反应生成硅和氯化氢;
①还原炉中SiHCl3和氢气发生反应生成硅和氯化氢;可循环使用的物质是参与反应过程,最后又从新生成的物质;石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳;
②根据题中数据,采用精馏(或蒸馏)方法提纯SiHCl3;
③SiHCl3水解生成硅酸、氢气和氯化氢;
(2)①由SiCl4和NH3反应制取Si3N4,根据反应物和生成物写出化学方程式;
②化学气相沉积法是两种或两种以上的气态原材料导入到一个反应室内,然后他们相互之间发生化学反应,形成一种新的材料,沉积到晶片表面上得较高纯度的氮化硅,根据反应物和生成物写出化学方程式;
③Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质.
解答 解:(1)①还原炉中SiHCl3和氢气发生反应制得纯硅,SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,流程分析可知可循环使用的物质为HCl和H2;用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,石英砂的主要成分是二氧化硅,制备粗硅发生置换反应,SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,同时,在反应中,也可能生成碳化硅,反应为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,
故答案为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;HCl和H2;SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;
②利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质;
故答案为:精馏(或蒸馏);
③SiHCl3水解反应生成硅酸、氢气和氯化氢,反应的方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑;
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑;
(2)①SiCl4和NH3反应生成Si3N4和氯化氢,反应化学反应方程式:3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
故答案为:3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
②SiCl4与N2、H2反应生成Si3N4,还应生成HCl,化学方程式为:3SiCl4+2N2+6H2 $\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
故答案为:3SiCl4+2N2+6H2 $\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
③由元素守恒判断,Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,利用SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质,可采用加入足量稀盐酸的方法,使MgO、Mg3N2溶解后过滤;
故答案为:SiO2;加足量稀盐酸过滤.
点评 本题考查了实验方案设计的有关知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,注意根据质量守恒书写化学方程式,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 14g | B. | 42g | C. | 56g | D. | 28g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )| A. | 正极一侧为有机电解液 | B. | 放电过程中LiOH在正极生成 | ||
| C. | 放电时Li+从正极区移向负极区 | D. | 专用充电电极可以是铁、铜等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
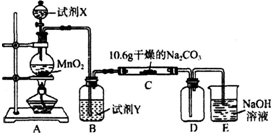
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
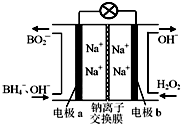 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| C. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| D. | 每消耗3 mol H2O2,转移的电子为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ks或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 | |
| C. | 碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 +Cl2+H2O=HCO-3+Cl-+HClO | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO2-4先形成沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①②⑤ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com